
22. The speech which he made ______ the project bothered me greatly.
A. being concerned B. be concerned C. concerned D. concerning
第一节:单项填空(共15小题,每小题1分,满分15分)
21. It’s really _______type I’ve been after, but I’d like to give it _______second thought.
A. a; 不填 B. a; the C. the; a D. the; the
34.将N2和H2按一定比例混合,其密度是相同状况下H2的3.6倍,取出0.5mol该混合气体充入密闭容器里,发生反应N2(g)+3H2(g) 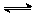 2NH3(g)
△H<0,在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前的0.8倍。试求:
2NH3(g)
△H<0,在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前的0.8倍。试求:
(1)写出此反应的化学平衡常数表达式;
(2)达到平衡时混合气体中氨的物质的量;
(3)平衡时N2的转化率。
2009-2010年度哈师大附中高三第三次月考
33.有A、B、C、D、E、F六种短周期元素,原子序数依次增大,其中A、D元素的原子最外层电子均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4;F元素原子最外电子层比同周期的E元素原子的最外层多4个电子,请回答:
(1)写出A、D两种元素组成的化合物的电子式 ;
(2)写出B、D、E三种元素组成的常见化合物的名称 ;
(3)工业生产E的化学方程式为 ;
(4)元素F位于元素周期表第 周期,第 族。
(5)D、F两元素最高价氧化物的水化物之间发生的反应的化学方程式
(6)D的氢氧化物和C的氢化物在水溶液中反应的离子方程式为
。
32.在一定条件下,在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
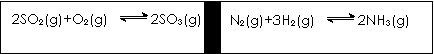
(1)若起始时两边分别投入2 mol SO2、1 mol O2;1 mol N2、3 mol H2,达到平衡后,隔板是否能处于中央 (填“能”或“否”)。
(2)若起始时投入2 mol SO2、1 mol O2;1 mol N2、2 mol H2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字);
(3)若起始时投入2 mol SO2、1 mol O2;1 mol N2、a mol H2、0.1 mol NH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围 。
31.盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
____________
30. 用电子式表示下列物质的形成过程:
(1)MgCl2:
(2)Br2:
29. 从能量的角度看,断开化学键要 ,形成化学键要 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com