
20.(11分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:(1)若甲的化学式为RCl3,其溶液在加热蒸于并灼烧时可发生如下反应:
a.甲+H2O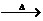 乙十丙 b.乙
乙十丙 b.乙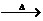 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是: 。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:____。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
(2)若甲、乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲十乙 丙。则:
丙。则:
①甲的结构式为 。
②写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式 。
21(12分)、某有机物X的相对分子质量小于100,1mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2112L。
⑴该有机物X的分子式为 。
a.C4H8 b.C2H4O c.C4H8O2 d.C10H20O20
⑵甲物质是X的同分异构体,分子中含有羰基和羟基,物质甲能发生如下图所示的转化:

已知: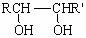
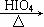 RCHO + R’CHO
RCHO + R’CHO
①B的名称是 。
②A→D的反应类型为 ,E→F的反应条件是 。
③写出B与银氨溶液,E→F的化学方程式: 。
⑶物质乙也是X的同分异构体,1mol乙与足量的Na反应可生成1molH2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上。乙的核磁共振氢谱图中有3个峰,面积比为2∶1∶1。则其结构简式为:
19.(11分)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
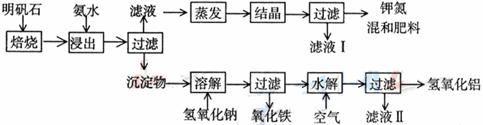
根据上述图示,完成下列天空:
⑴明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨) mL,用规格为 mL量筒量取。
⑵氨水浸出后所得滤液I的成分是水和 ,沉淀物中所含物质的化学式为 。
(3)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
(4)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
mol(用含m、n的代数式表示)。
18.(8分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
请回答下列问题:
(1)反应①的化学方程式为

(2)反应②的离子方程式为

(3)写出另外一种实验室制取H的化学方程式




 (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
17.(4分)现有以下物质:A:Na2O2 B:Al(OH)3 C:纯盐酸 D:CaClO·Cl
E:O3 F:HF G:Fe(OH)3胶体 H:液氨
(1)属于氧化物的是: (2)属于混合物的是:
(3)属于弱电解质的是: (4)属于非电解质的是:
16. 下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
15. 下列有在叙述正确的是
A.室温下,HClO分子不可能存在于c(OH-)>c(H+)的溶液中
B.室温下,在pH=7的溶液中,CH3COO-不可能大最存在
C.漂白粉只有在酸的存在下生成次氯酸才具有漂白作用
D.c(CH3COO-)=c(Na+)的CH3COOH和CH3COONa混合溶液呈中性
14.向一定量的Fe.FeO.Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S.T.P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素的质量分数为
A. 81.4% B. 77.8% C. 68.6% D. 无法计算
13. 所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
|
|
Na |
Cu |
Al |
Fe |
|
熔点(0C) |
97.5 |
1083 |
660 |
1535 |
|
沸点(0C) |
883 |
2595 |
2200 |
3000 |
其中不能形成合金的是
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
12.相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
 2SO2(g)+O2(g) 2SO3(g);
2SO2(g)+O2(g) 2SO3(g);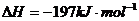 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
|
容器 |
起始各物质的物质的量/mol |
达到平衡时体系能量的变化 |
|||
|
SO2 |
O2 |
SO3 |
Ar |
||
|
甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
|
乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
|
丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
下列叙述正确的是
A.Q1=Q2=Q3=197 kJ
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
11. 下列化合物的核磁共振氢谱中出现三组峰的是:
A.2,2,3,3一四甲基丁烷 B.2,3,4一三甲基戊烷
C.3,4一二甲基己烷 D.2,5一二甲基己烷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com