
8、下列表示电子式的形成过程正确的是:( )
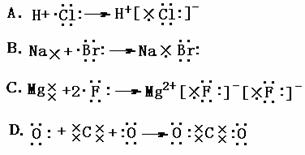

7、关于氢键,下列说法正确的是( )
A、氢键比范德华力强,所以它属于化学键
B、分子间形成的氢键使物质的熔点和沸点升高
C、由于NH3和H2O之间可形成分子间氢键,使氨在水中溶解度增大
D、H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
6、下列各项表达正确的是( )
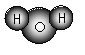 A.H2O的分子模型示意图:
B.F-的结构示意图:
A.H2O的分子模型示意图:
B.F-的结构示意图: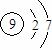
C.乙烯分子的结构简式:CH2CH2
D.CaCl2的电子式: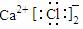
5、下列分子中所有原子最外层都满足8电子结构的是( )
A、次氯酸(HClO) B、CF2Cl2 C、三氟化硼(BF3) D、白磷(P4)
4、下列物质中属于含有极性共价键的离子化合物的是( )
A、过氧化钠 B、碘化氢 C、苛性钠 D、氯化钾
3、同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
A.它是一种共价化合物 B.它既含离子键又含共价键
C.它不可能与NaOH溶液反应 D.它受热时,可能会分解产生有色气体
2、 下列叙述中,不正确的是( )
下列叙述中,不正确的是( )
A.不同的原子之间只能构成共价化合物
B.单质中不一定存在非极性键
C.非金属原子之间只能构成共价化合物
D.Cl2的沸点比F2高,这与分子间作用力的大小有关
(1)键长:__________________核间距离。
键长决定分子的稳定性,一般说来,键长越___,键越___,也越稳定。键长的大小与成键微粒的半径大小有关。如键和H-Cl_H-Br_H-I,则稳定性:H-Cl_H-Br_H-I。
(2)键能:拆开1 mol某键所需的能量叫键能。单位:_____。键能决定分子的稳定性,键能越_,键越_,分子越_。
(3)键角:________的夹角。
 键角决定分子的空间构型,凡键角为180°的为_____,如:
键角决定分子的空间构型,凡键角为180°的为_____,如: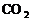 ;凡键角为109°28′的为_____体,如:
;凡键角为109°28′的为_____体,如: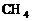 。
。
[典型例题]
例1下列说法中正确的是 A、离子键是阴阳离子间存在的静电引力 B、失电子难的原子获得电子的能力一定强 C、在化学反应中,某元素由化合态态变为游离态,该元素被还原。 D、电子层结构相同的不同离子,其半径随核电荷数增多而减少。 答案为D。 例2下列叙述正确的是 A、两种非金属原子间不可能形成离子键。B、非金属原子间不可能形成离子化合物。 C、离子化合物中可能有共价键。 D、共价化合物中可能有离子键。 答案为A、C。 例3 以下叙述中错误的是
A. 钠原子与氯气反应生成食盐后,其结构的稳定性增强
B. 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子,原子核与原子核之间的排斥作用
C. 任何离子键在形成过程中必定有电子的得与失
D. 钠与氧气反应生成氧化钠后,体系的能量降低
答案:C。
例4有A、B、C、D四种元素。已知:A的最高正价与其最低负价的代数和为6,A、D次外层电子都是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴,阳离子,B有两个电子层,其最高正价与最低负价的代数和为零;C2-离子与氪原子具有相同的电子层结构。试写出: (1)上述各元素的符号:A_____B_____C_____D_____。 (2)DA的电子式为________。 答案:(1)Cl、C、Se、K。
[基础练习]
1、下列说法中,不正确的是( )
A.双原子分子中的共价键,一定是非极性键
B.非极性键也可能存在于离子化合物中
C.分子间作用力,又叫范德华力,它比化学键要弱得多
D.共价化合物在液态时不能导电
1分子间作用力
①概念:分子之间存在着一种把分子 叫做分子间作用力,又称 。
②强弱:分子间作用力比化学键 ,它主要影响物质的 、 、
等物理性质,化学键属分子内作用力,主要影响物质的化学性质。
③规律:一般来说,对于组成和结构相似的物质, 越大,分子间作用力 ,物质的熔点、沸点也越 。
④存在:分子间作用力只存在于由分子组成的共价化合物、共价单质和稀有气体的分子之间。在离子化合物、金属单质、金刚石、晶体硅、二氧化硅等物质中只有化学键,没有分子间作用力。
2氢键
①概念:像 、 、 这样分子之间存在着一种比 的相互作用,使它们只能在较高的温度下才能汽化,这种相互作用叫做氢键。
②对物质性质的影响:分子间形成的氢键会使物质的熔点和沸点 ,这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗更多的能量。
(1)定义:使 相结合或 相结合的 通称为化学键。

(3)化学反应的实质:物质发生化学变化的过程就是旧化学键 与新化学键 的过程。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com