
4.对中国资本主义工业兴起的叙述,不正确的是
A、受外商企业的刺激 B、由部分官僚、地主、商人投资
C、都由政府企业分化出来 D、主要分布在沿海地区
3.刘邦即位之初曾下令:“贾人不得衣丝乘车”,其夫人吕后当政时强调:“市井之子孙不得为官仕吏”。这说明西汉初年实行的是
A、休养生息政策 B、限制商人的政策
C、禁止经商的 D、反腐倡廉的政策
2. “富者田连阡陌,贫者无立锥之地”是中国古代经济生活中普遍的现象,造成这种现象的原因是:
A、土地兼并 B、重农抑商 C、闭关政策 D、贫富分化
1.黄梅戏《天仙配》中七仙女的唱段“你耕田来我织布”反映了中国古代
A、农业的基本特点之一 B、手工业的基本特点之一
C、商业的基本特点之一 D、重农抑商的基本特点之一
0.01mol 0.56g
△ m2 -△m1 = 0.24g. △m2=△m1 +0.24g=0.56g+0.24g=0.80g
设CuO的物质的量为x, CuSO4的物质的量也为x,
② Fe + CuSO4 = FeSO4 + Cu △m2
1mol 8g
X 0.80g
解得: X=0.1mol
m(CuO)= 0.1mol•80g/mol=8 g
g
例4、将12.8克由CuSO4和Fe组成的固体,加入足量的水中充分反应后,滤出固体,干燥后称得5.2克。求原混合物中CuSO4和Fe各为多少克?
解析: 此题有三种反应可能:恰好完全反应、CuSO4过量、Fe过量。
余下固体有两可能:(1)余下Fe和Cu;(2)余下全是Cu.
(1)当余下固体是Fe和Cu(即Fe过量)时,设x克CuSO4耗尽,则铁为(12.8-x)克,置换差量为5.2-(12.8-x)克。
CuSO4 + Fe 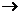 FeSO4 +Cu 固体增重
FeSO4 +Cu 固体增重
160 56 64 64-56=8(理论差量)
x
5.2-(12.8 -x)(实际差量)
-x)(实际差量)
160:x=8:[5.2-(12.8-x)]
∴ x=8(克),12.8-x=4.8(克)。
(2)设余下固体全是Cu,反应时有w克Fe耗尽。
CuSO4 + Fe 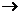 FeSO4+ Cu 固体增重
FeSO4+ Cu 固体增重
56 64 64-56=8(理论差量)
 W
5.2-w(实际差量)
W
5.2-w(实际差量)
56:w=8:5.2-w
∴ w=4.55(克),
则原混合物中CuSO4为12.8-4.55=8.25(克)。
而8.25克CuSO4中只含8.25×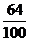 =3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。
=3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。
答案:原混合物中CuSO4为8克,Fe为4.8克。
例5、在某些硫酸铜溶液中,加入一个质量为1.12g的铁片,经过一段时间,铁片表面覆盖了一层红色的铜,取出洗净、烘干,称重,质量变为1.16g.计算在这个化学反应中溶解了铁多少克?析出了铜多 少克?
少克?
解析:Fe+C uSO4=FeSO4+Cu,从化学方程可以看出,铁片质量的增加,与铁的溶解和铜的析出直接联系,每溶解56g铁,将析出64g铜,会使铁片,质量增加: 64g-56g=8g
uSO4=FeSO4+Cu,从化学方程可以看出,铁片质量的增加,与铁的溶解和铜的析出直接联系,每溶解56g铁,将析出64g铜,会使铁片,质量增加: 64g-56g=8g
根据铁片增加的质量(1.16g-1.12g),可计算出溶解的Fe的质量和析出的Cu的质量.
解:设溶解的Fe为xg,析出的Cu为yg
Fe=CuSO4=Cu+FeSO4 质量差
56 64 64-56
x y 1.16-1.12
则: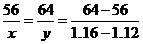 ,解
,解 得:x=0.28(g) y=0.32(g)
得:x=0.28(g) y=0.32(g)
答:在这个化学反应中溶解了铁0.28g析出了铜0.32g.
例6.将质量为100克的铁棒插入硫酸铜溶液中,过一会儿取出,烘干,称量,棒的质量变为100.8克。求有多少克铁参加了反应。

例7.agNa2CO3和NaHCO3混合物加热至质量减少到bg,则混合物 中NaHCO3的质量分数为: 。
中NaHCO3的质量分数为: 。
解:设NaHCO3的质量为x
2NaHCO3====Na2CO3+H2+CO2↑ △m
168g 106g 168g-106g=62g
x (a-b)g
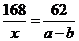 解得x=
解得x=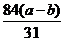
得NaHCO3的质量分数为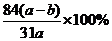
例8.有NaCl和NaBr的混合物16.14g,溶解于水中配成溶液.向溶液中加入足量的AgNO3溶液,得到33.14g沉淀.则原混合物中钠元素的质量分数为( )
A.28.5% B.50%  C.52.8% D.82.5%
C.52.8% D.82.5%
解: NaCl+AgNO3=AgCl↓+NaNO3; NaBr+AgNO3=AgBr↓+NaNO3
即:NaCl→AgCl, NaBr→AgCl银元素替换了钠元素.因此沉淀比混合物增重部分就是银元素比钠元素增重的部分。设Na元素的质量为x
Na → Ag △m
23g 108g 08g-23g=85g
x 33.14g-16.14g=17g
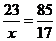 解得:x=4.6g
所以Na%=4.6g/16.14g=28.5%
解得:x=4.6g
所以Na%=4.6g/16.14g=28.5%
例9.在密闭容器中,放入(NH4)2C O3和NaOH的混合物共ag,将容器加热至200℃,经充分反应后,排除其中的气体,冷却,称得剩余固体质量为bg,求容器中(NH4)2CO3和NaOH各多少克?
O3和NaOH的混合物共ag,将容器加热至200℃,经充分反应后,排除其中的气体,冷却,称得剩余固体质量为bg,求容器中(NH4)2CO3和NaOH各多少克?
解:(本题中ag(NH4)2CO3和NaOH的混合物,在加热时(NH4)2CO3与NaOH要发生反应,因
② 若(NH4)2CO3过量,剩余的(NH4)2CO3在加热时还要分解生成NH3、H2O和CO2气体,则此时bg固体全部是Na2CO3。根据钠元素质量守恒有
n(NaOH)=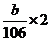 , 则m(NaOH)=40×
, 则m(NaOH)=40×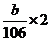
m((NH4)2CO3)=a-40×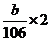
例10.将4.66g卤素互化物BrClx溶于水后,通入足量SO2气体与其反应生成氢溴酸、盐酸和硫酸,再用碱将溶液调至中性后,加入过量Ba(NO3)2溶液,充分反应后滤去沉淀物,再向滤液中加入过量AgNO3溶液,最后得卤化银沉淀15.46g。试计算:
(1)参加反应的AgNO3的物质的量。
(2)BrClx中的x值。
解:质量增加的是Ag的质量
所以n(AgNO3)=
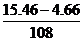 =0.1
(mol)
=0.1
(mol)
设4.66g卤素互化物BrClx为a mol
BrClx → AgBr + xAgCl 质量增加
1mol
108(1+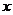 )
)
a mol 15.46g-4.66g
则: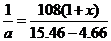 a=
a=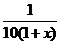
所以: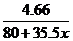 =
=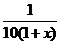
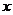 =3
=3
例11.把6.1g干燥纯净的氯酸钾和二氧化锰的混合物放在试管里加热,当完全分解、冷却后称得剩余固体质量为4.2g,求原混合物里氯酸钾有多少克?
解析:根据质量守恒定律,混合物加热后减轻的质量即为生成的氧气质量(W混-W剩=WO2),
例12. 将盛有12gCuO的试管通入氢气后加热,当冷却后试管内的固体残渣为10g时,求氧化铜被还原的质量分数?
解析:此题经分析,12gCuO没有完全反应,生成物的残渣10g中也有没有反应的CuO。用常规解法较烦琐,如果用差量法则较为简便。但一定要分析清楚,减重的质量是哪种元素,在这题里减重的是CuO中的氧元素,它与H2结合成为H2O。根据方程式分析:设参加反应的CuO质量为y。
例13.将12克CO和CO2的混合气体通过足量灼热的氧化铜后,得到气体的总质量为18克,求原混合气体中CO的质量分数。
解析:CO+CuO-Cu+ CO2
28 44
由化学方程式可知,气 体质量增加的原因是CO夺取了氧化铜中的氧元素。每28份质量的CO参加反应,可生成44份质量的CO2,使气体质量增加44-28=16(份)。现已知气体质量增加18克-12克=6克,据此可列比例求解。
体质量增加的原因是CO夺取了氧化铜中的氧元素。每28份质量的CO参加反应,可生成44份质量的CO2,使气体质量增加44-28=16(份)。现已知气体质量增加18克-12克=6克,据此可列比例求解。

例14.将氢气通入10g灼热的氧化铜中,过一段时间后得到8.4g固体,下列说法正确的是( )
(A)有8.4g铜生成
(B)有8g氧化铜参加反应
(C)有1.6g水生成
(D)有10g氧化铜被还原
解析:根据题意,10g氧化铜不一定全部参加反应,所以得到的8.4g固体也不一定都是铜的质量。我们可以利用“固体-固体”差量法解决此题。反应前后固体的质量差(10-8.4=1.6g)=参加反应的氧化铜的质量-生成的铜的质量=CuO-Cu,即理论上每80份质量的CuO参加反应转化为64份质量的Cu,固体质量减少16份,据此可列比例求解。
H2+CuO-Cu+H2O △m(固体质量减少)
80 64 18 80-64=16
x y z 10-8.4=1.6g
可以求出 x=8g,y=6.4g,z=1.8g,则有8g铜参加反应,6.4g铜生成,1.8g水生成。
x=8g,y=6.4g,z=1.8g,则有8g铜参加反应,6.4g铜生成,1.8g水生成。
答案:B
例15.用含杂质(杂质不与酸作用,也不溶于水)的铁10克与50克稀硫酸完全反应后,滤去杂质,所得液体质量为55.4克,求此铁的纯度。
解析:Fe+H2SO4(稀)=FeSO4+H2↑
由化学方程式可知,影响溶液质量变化的因素是参加反应的铁和生成的氢气。每有56份质量的铁参加反应“进入”溶液中的同时,则可生成2份质量的氢气从溶液中逸出,故溶液质量增加Fe-H2,即56-2=54(份)。由题目给的差量55.4克-50克=5.4克,据此便可列比例求解。

3. 优点:只与反应前后相应的差量有关,不必追究各成分在反应前和后具体的量.能更深刻地抓住本质,提高思维能力.
例1.有NaCl和KCl的混合物25g,溶于水形成溶液,加入1000g 7.14%的AgNO3溶液,充分反应后滤出沉淀,再向混合物加入100g Cu片,过一段时间取出(反应完全),洗涤干燥称其质量为101.52g,求原混合物中NaCl和KCl的物质的量各为多少?
解:设与Cu反应的硝酸银的物质的量为x
Cu ~ 2AgNO3 ~ 2Ag △m
64 2mol 2×108 152
xmol 1.52g
解得:x=0.02mol
n(AgNO3)=1000g×7.14%/170g/mol
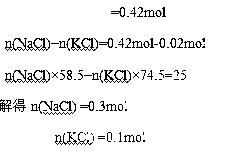
例2.取一定量的CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g. 并收集到224mL气体(标准状况)。求此CuO粉末的质量。
解析:由题意可知,CuO粉末与稀硫酸充分反应后,硫酸过量。
引起铁棒质量变化时涉及到下列两个反应:
① Fe + H2SO4 = FeSO4 + H2
② Fe + CuSO4 = FeSO4 + Cu
其中第①个反应使铁棒质量减少,第②个反应使铁 棒质量增加,两者的代数和为0.24g。
棒质量增加,两者的代数和为0.24g。
①
Fe + H2 SO4 = FeSO4 + H2 △m1
SO4 = FeSO4 + H2 △m1
56g 1mol 56g
2. 注意: ① x、y可表示物质的质量、物质的量、气体体积等,因而差量可指质量之差(△m)物质的量之差(△n)或气体体积之差(△V)等.
② 分清“差量”是增还是减.在较复杂的情况,存在多个反应,可能差量的增减方向并不一致,这就要取其代数和.若方向相同,则总差量等 于各个分差量之和.
于各个分差量之和.
③ 正确分析形成差量的原因,找出对应的根据方程式得出的“理论差量”是差量法解题的关键.
1. 原理::对于任意一个化学反应,涉及到各物质的数量间,一般都有一定的关系.如任取两种物质的物理量,分别为x,y. 当x 值增大或减小时,y也成比例地变化.且x与y的差值也呈相 应变化.
应变化.

 数学表达式为:
数学表达式为: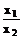 =
=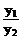 =
=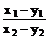
12.如图所示,两个用轻线相连的位于光滑水平面上的物块,质量分别为m1和m2,拉力F1和F2方向相反,与轻线沿同一水平直线,且F1>F2.试求两个物块运动过程中轻线的拉力T.[2004年高考·全国理综卷]
 解析:设两物块一起运动的加速度为a,则有:
解析:设两物块一起运动的加速度为a,则有:
F1-F2=(m1+m2)a
根据牛顿第二定律,对质量为m1的物块有:
F1-T=m1a
解得:T= .
答案:
11.如图所示,物体从光滑斜面上的A点由静止开始下滑,经过B点后进入水平面(设经过B点前后速度大小不变),最后停在C点.每隔0.2秒通过速度传感器测量物体的瞬时速度,下表给出了部分测量数据.取重力加速度g=10 m/s2,求:
|
t/s |
0.0 |
0.2 |
0.4 |
… |
1.2 |
1.4 |
… |
|
v/(m·s-1) |
0.0 |
1.0 |
2.0 |
… |
1.1 |
0.7 |
… |
(1)斜面的倾角α.
(2)物体与水平面之间的动摩擦因数μ.
(3)t=0.6 s时的瞬时速度v.[2007年高考·上海物理卷]
解析:(1)由前三列数据可知物体在斜面上匀加速下滑时的加速度a1==5 m/s2,由mgsin α=ma1,可得:α=30°.
(2)由后两列数据可知物体在水平面上匀减速滑行时的加速度大小a2==2 m/s2,μmg=ma2
可得:μ=0.2.
(3)设0.4 s后再经过t时间物体滑至B点,有:
2+5t=1.1+2(0.8-t)
解得:t=0.1 s
即物体在斜面上下滑的时间为0.5 s,则t=0.6 s时物体在水平面上,设物体在0.6 s时的速度为v,有:
v1.2=v-a2(1.2-0.6)=1.1 m/s
解得:v=2.3 m/s.
答案:(1)30° (2)0.2 (3)2.3 m/s
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com