
4.“百家争鸣”局面的形成与下列诸因素有关系的是
①封建经济的迅速发展 ②私学的兴盛③各国纷争的社会环境 ④社会的剧烈变革
A.①② B.③④ C.②③④ D.①②③④
3.战国时期下列哪一思想对于打击奴隶主贵族特权具有积极意义
A.“兼爱”、“非攻” B.“法不阿贵” C.“民贵君轻” D.“自然无为”
2.孔子“仁”的思想在先秦时期的进步意义主要是
A.满足新兴地主阶级的政治需要 B.抑制统治者的暴政
C.成为各国变法的理论依据 D.奠定“非攻”主张的思想基础
1.战国时期,一些思想家聚在一起进行辩论:“兼相爱,交相利”“邻国相望、鸡犬之声相闻,民至老死不相往来”“明主峭其法而严刑,威势之町以禁暴,而德厚不足以止乱”。根据这些文字,判断哪些学派的思想家参加了这次聚会 ①儒家 ②道家③法家 ④墨家
A.①②③ B.①②④ C.②③④ D.①②③④
25. (4分)常温下有一pH为12的NaOH的溶液100mL,如果将其PH降为11,那么 (1)若用蒸馏水应加入 mL (2)若用pH=10的NaOH溶液应加入 mL (3)若用pH=2的盐酸应加入 mL;
长春外国语学校2008-2009学年第二学期期末
28.(11分)某学生为测定未知盐酸溶液的浓度,将1.00mL待测盐酸配制成100mL稀盐酸溶液;以0.14mol·L-1的NaOH溶液滴定上述稀盐酸25.00mL,滴定终点时消耗NaOH溶液15.00mL。该学生用标准0.14mol·L-1 NaOH溶液滴定稀盐酸的实验操作如下:
A、用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入两滴酚酞
B、用稀盐酸溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
(1)滴定操作的正确顺序是(用序号填写)E→ →D→ → → →F。
(2)在G操作中如何确定终点? 。
(3)如有1mol/L和0.1mol/L的NaOH溶液,应选用 的NaOH溶液,原因是 。
(4)用标准NaOH溶液滴定时,应将标准NaOH溶液注入滴定管 (选填“甲”或“乙”)中。
(5))试分析下列实验操作可引起哪些误差(选填“偏大”“偏小”或“无影响”)。
A、转移待测液至容量瓶时,末洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读滴定管开始时仰视,读终点时俯视
(6)待测盐酸溶液(稀释前的盐酸溶液)的物质的量浓度为 mol/L(计算结果到小数点后二位)。
27.(11分)已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子:
(1)若溶液中只溶解了一种溶质,该溶质是 (填化学式),上述离子浓度由小到大的顺序是 (填离子的浓度符号顺序)。
(2)若溶液中两种离子浓度关系为c(Na+) =c(CH3COO-),则该溶液显 性(填“酸”、“中”、“碱”)。 该溶液中的溶质可能是 (填化学式)。
(3)若该溶液由体积相等的醋酸和氢氧化钠溶液混合而成,混合后溶液呈酸性,则混合前溶液中的c(CH3COOH)
c(NaOH)(填>或=或<)。该溶液中存在的三个平衡体系是H2O H++OH-、_________________________和__________________________(用离子方程式表示)。
H++OH-、_________________________和__________________________(用离子方程式表示)。
(4)25℃时,将pH=a的醋酸VamL和pH=14-a的氢氧化钠溶液VbmL混合,若溶液显碱性,则Va Vb(填>或=或<)。
26.(10分) (1)氯化铝水溶液呈 性(填“酸”、“中”、“碱”),常温时pH 7
(填>或=或<),原因是(用离子方程式表示) 。实验室配制氯化铝溶液时,为了抑制水解,可以加入少量的 。把氯化铝溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)硫化钠水溶液中:①C(Na+) 2C(S2-)(填>或=或<,下同)② C(H+) C(OH-),原因是(用离子方程式表示) 。
19. 在密闭容器中发生反应:aX(气)+bY(气)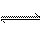 cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
A.平衡向逆反应方向移动 B.a + b > c + d
C. Z的体积分数减小 D.X的转化率下降
18.一定条件下,在容积为2L的密闭容器里加入一定物质的量的A和B,发生如下反应并建立平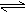 衡:A(g)
2B(g) C(g)+2D(g) 测得平衡时各物质的浓度是:[A]=0.3 mol/L,[B]=0.2 mol/L,[C]=0.15 mol/L。最初向容器里加入A的物质的量是( )
衡:A(g)
2B(g) C(g)+2D(g) 测得平衡时各物质的浓度是:[A]=0.3 mol/L,[B]=0.2 mol/L,[C]=0.15 mol/L。最初向容器里加入A的物质的量是( )
A 0.5 mol B 0.8 mol C 0.9 mol D 1.2 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com