
9、 有四个游戏盘,如果撒一粒黄豆落在阴影部分,则可中奖。小明希望中奖概率最大,他应当选择的游戏盘是( )
有四个游戏盘,如果撒一粒黄豆落在阴影部分,则可中奖。小明希望中奖概率最大,他应当选择的游戏盘是( )

8.三位七进制的最大数表示成十进制的数是( )
A.322; B.332; C.342; D.352
7、从一批产品中取出三件,设A=“三件产品全不是次品”,B=“三件产品全是次品”,C=“三件产品不全是次品”,则下列结论正确的是( )
A.A与C互斥 B.B与C互斥
C.任两个均互斥 D.任两个均不互斥
6.右边程序执行后输出的结果是( )
A.-1 B.2 C.1 D.0
5、样本4,2,1,0,-2的标准差是( )
A.2 B.4 C. 1 D.
4、将两个数a=8,b=17交换,
使a=17,b=8,下面语句正确一组是 ( )
A. B. C. D.

|
|
|
|
||||||||
3、 条件语句的一般形式如右图所示,其中B表示的是( )
条件语句的一般形式如右图所示,其中B表示的是( )
A.条件 B.条件语句
C.满足条件时执行的内容
D.不满足条件时执行的内容
2、某公司现有一般职员160人,中级管理人员30人,高级管理人员10人,要从其中抽取20个人进行身体健康检查,如果采用分层抽样的方法,则一般职员、中级管理人员和高级管理人员应该各抽取多少人( )
A.8,15,7 B.16,2,2 C.16,3,1 D.12,5,3
1、掷一枚骰子,则掷得奇数点的概率是( )
A.  B.
B.  C.
C. 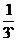 D.
D. 
⒈ 判断混合物的组成
例⒈ 某合金15g,在足量氯气中充分燃烧,反应后固体质量增加了35.5g,则合金的组成可能是( )
A. Fe、Al B. Mg、Al C. Cu、Mg D. Fe、Zn
解析:在此反应中Fe、Mg、Al、Cu、Zn的摩尔电子质量分别为18.67、12、9、32、32.5。合金的平均摩尔电子质量为 =15
=15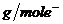 ,由中间数值法得A、C两项正确。
,由中间数值法得A、C两项正确。
例⒉ 由Na、Mg、Al、Fe四种金属单质中的两种组成的合金共12g,跟足量盐酸反应,产生5.6LH2(标况),由此可判断混合物中必定含有( )
A.Na B.Mg C.Al D.Fe
解 析:Na、Mg、Al、Fe的摩尔电子质分别为23、12、9、28,混合物的平均摩尔电子质量是
析:Na、Mg、Al、Fe的摩尔电子质分别为23、12、9、28,混合物的平均摩尔电子质量是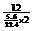 =24,只有Fe的摩尔电子质量大于24,故必有Fe。
=24,只有Fe的摩尔电子质量大于24,故必有Fe。
例3:锰的氧化物MnO2、Mn2O3、Mn3O4、Mn2O7在加热时均能和浓盐酸发生反应生成MnCl2 和Cl2,现有11.45g锰的某种氧化物与足量的盐酸反应,产生的 氯气在标准状况下的体积为1.12升,则参加反应的氧化物是( )
氯气在标准状况下的体积为1.12升,则参加反应的氧化物是( )
A.MnO2 B.Mn2O3 C.Mn3O4 D.Mn2O7
解析:由题意可知,该锰的氧化物的摩尔电子质量为 =114.5。考查各选项,MnO2的摩尔电子质量为
=114.5。考查各选项,MnO2的摩尔电子质量为 =43.5,Mn2O3的摩尔电子质量为
=43.5,Mn2O3的摩尔电子质量为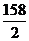 =79,Mn3O4的摩尔电子质量为
=79,Mn3O4的摩尔电子质量为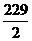 =114.5,Mn2O7的摩尔电子质量为
=114.5,Mn2O7的摩尔电子质量为 =22.2,所以应选C。
=22.2,所以应选C。
例4:某钾与氧气化合形成的物质20g,投入到足量氢硫酸溶 液中,经充分反应后只产生8 g沉淀(无气体放出),则该物质的组成( )
液中,经充分反应后只产生8 g沉淀(无气体放出),则该物质的组成( )
A.K2O和K2O2混合物 B.K2O2 C.KO2 D.K2O2和KO2混合物
解析:K2O与H2S不发生氧化还原反应,故其摩尔电子质量为+∞,K2O2的摩尔电子质量为 =55,
=55,
KO2的摩尔电子质量为 =23.67,题中沉淀为硫,则该钾化合物的摩尔电子质量为
=23.67,题中沉淀为硫,则该钾化合物的摩尔电子质量为 =40,所以,由中间数值得,应选D。
=40,所以,由中间数值得,应选D。
⒉ 判断产物的组成
例5:30g铁与一定量是某浓度硝酸溶液恰好反应,放出标准状况下11.2升NO气体,则在生成的溶液里存在的金属阳离子是( )
A.Fe2+ B.Fe3+ C.Fe2+ 和Fe3+ D.无法判断
解析:Fe → Fe2+时摩尔电子质量为28,Fe → Fe3+时摩尔电子质量是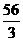 =18.67。而由题给条件,算出铁的摩尔电子质量为
=18.67。而由题给条件,算出铁的摩尔电子质量为 =20,故应选C。
=20,故应选C。
例6:6.2g磷在标准状况下8.96升氯气中恰好充分燃烧,则所得产物是( )
A.PCl3 B.PCl5 C.PCl3和PCl5 D.无法判断
解析: →
→ 时摩尔电子质量是
时摩尔电子质量是 =10.33,
=10.33, →
→ 时摩尔电子质量是
时摩尔电子质量是 =6.
=6. 2而由题给条件算出磷的摩尔电质量为
2而由题给条件算出磷的摩尔电质量为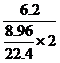 =7.75。故应选出C。
=7.75。故应选出C。
⒊ 混合物中各组分含量的计算
例7:30g铁与一定量某浓度硝酸溶液恰好反应,放出标准状况下11.2升NO气体,则在所得溶液中金属阳离子是 ,其物质的量 。
解析:金属阳离子的判断方法见例题5。第二空解析如下,Fe2+对应铁的摩尔电子质量是28,Fe3+对应铁的摩尔电了质量是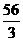 ,而题给的铁的摩尔电了质量是
,而题给的铁的摩尔电了质量是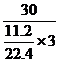 =20,则“十字交叉法”得:
=20,则“十字交叉法”得:
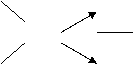 28
28

20
=
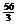 8,
8,
注意,这里的1:6是Fe Fe2+,Fe
Fe2+,Fe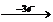 Fe3+时Fe失去的电子数之比则
Fe3+时Fe失去的电子数之比则 =
= ,由此不难算出Fe2+ 和Fe3+的物质的量分别是.0108mpl、0.425mol。
,由此不难算出Fe2+ 和Fe3+的物质的量分别是.0108mpl、0.425mol。
例8:15g铁铝合金与足量盐酸反应,产生标准状况下H211.2升,则合金中铁,铝的质量分数各为多少?
解析:此题中Fe的摩尔电子质量为28,铝的摩尔电子质量为9,合金的平均摩尔电子质量为 =15。由“十字交叉法”:
=15。由“十字交叉法”:
 28
6
28
6
15
=
6 13
13
即:铁和铝失去电子数之比为6:13,则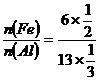 =
=
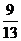 ,所以Fe的质量分数为:
,所以Fe的质量分数为: =59%,Al的质量分数为41%。
=59%,Al的质量分数为41%。
例9、分别将Na、Mg、Al、Fe、Zn投入到足量的稀硫酸中,完全反应后,若放出相同体积的气体,则Na、Mg、Al、Fe、Zn的质量比为 。
解析: 因放出的H2体积相同,则金属失电子的物质的量相同。依第一个表达式可知:质量比等于其摩尔电子质量比。即:23/1 :24/2 :27/3 :56/2 :65/2 =23 :12 :9 :28 :32.5
例10、两种金属的混合粉末15g,与足量盐酸充分反应后得到标况下H2 11.2L,则下列金属不可能的是:
A、Mg和Zn B、Fe和Zn C、Al和Na D、Al和Fe E、Mg和Cu
 例11、现有一金属混合物2.0g与足量的Cl2完全反应后增重7.1g,则该金属混合物不可能是:
例11、现有一金属混合物2.0g与足量的Cl2完全反应后增重7.1g,则该金属混合物不可能是:
A.Na、Mg B.Mg、Al C .Fe、Al D.Cu、Ag
.Fe、Al D.Cu、Ag
解析:先算混合金属的平均摩尔电子质量,再依据各金属的摩尔电子质量进行判定,即可求解。
 Me-=2.0/2×0.1=10g/mol·e -
Me-=2.0/2×0.1=10g/mol·e -
对应列出所给金属的摩尔电子质量(单位:g/mol·e-):
Na:23 Mg:12 Al:9 Fe:18.67 Cu:32 Ag:108
其平均值能达到10的是B、C,而A、D均大于10, 故选A、D。
故选A、D。
例12、有不纯的CuCl2,质量为13.5g,与适量的AgNO3溶液反应,可生成29g沉淀,则该氯化 铜中所含的杂质是下列中的
铜中所含的杂质是下列中的
A、KCl B、CaCl2 C、BaCl2 D、NaCl
解:此题的正常解法是分别写出各种物质与硝酸银溶液反应的化学方程式,然后逐个进行计算,最后得出答案。但如把摩尔电子质量法作进一步延伸,可快速解 答。
答。
现类比得出氯化物混合物与AgNO3溶液反应后,每生成1mol AgCl沉淀 时的平均质量为:
时的平均质量为:
 m =13.5/(29/143.5)=66.8(g),而CuCl2及所列氯化物每生成1mol AgCl沉淀时的质量分别为:CuCl2:67.5 g
m =13.5/(29/143.5)=66.8(g),而CuCl2及所列氯化物每生成1mol AgCl沉淀时的质量分别为:CuCl2:67.5 g  KCl :74.5 g CaCl2 :55.5g BaCl2 :104 g
NaCl :58.5g因要达到平均值为66.8,故应选B、D。
KCl :74.5 g CaCl2 :55.5g BaCl2 :104 g
NaCl :58.5g因要达到平均值为66.8,故应选B、D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com