
1、(A重)1815年,一场决定着欧洲历史命运的大决战在布鲁塞尔以南约20公里处开展。这场战役彻底结束了拿破仑的军事生涯和政治生命。此战即是( )
A.土伦战役
B.奥斯特里茨战役 C.莱比锡会战 D.滑铁卢战役
(B实择)恩格斯在《德国状况》中评论道:“在法国已完成其任务的恐怖统治,拿破仑以战争的形式把它搬到了其他国家,这种恐怖统治德国是十分需要的。”这是因为拿破仑( )
①是专横暴君和战争狂人
②取消了“神圣罗马帝国”
③减少了德意志小邦数目
④把法典带到被征服地区
A.①②④ B.①②③ C.②③ D.②③④
2.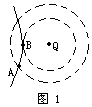 如图1所示,在点电荷+Q形成的电场中有一个带电粒子通过,其运动轨迹如图中实线所示,虚线表示电场的两个等势面,则
[ ].
如图1所示,在点电荷+Q形成的电场中有一个带电粒子通过,其运动轨迹如图中实线所示,虚线表示电场的两个等势面,则
[ ].
A.等势面电势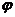 A<
A<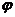 B,粒子动能EKA>EKB
B,粒子动能EKA>EKB
B.等势面电势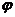 A>
A>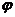 B,粒子动能EKA>EKB
B,粒子动能EKA>EKB
C.等势面电势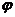 A>
A>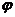 B,粒子动能EKA<EKB
B,粒子动能EKA<EKB
D.等势面电势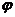 A<
A<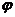 B,粒子动能EKA<EKB
B,粒子动能EKA<EKB
答案:1.A、B、D,2.A.
静电场的应用举例
重点讨论以下内容:
(1)带电粒子在电场中的平衡问题;
(2)带电粒子在电场中的非平衡问题
(3)电容器.
(1)平衡问题.
注意:共点力平衡条件。
[例题1)用两根轻质细线把两个质量未知的带电小球悬挂起来,a球带电+q,b球带电-2q,且两球间的库仑力小于b球受的重力,即两根线都处于竖直绷紧状态.若突然增加一个如图2中所示的水平向左的匀强电场,待最后平衡时,表示平衡状态的图可能是 [ ].
分析及解答:
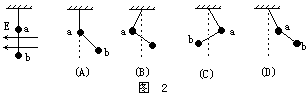
(2)非平衡问题.
[例题2]
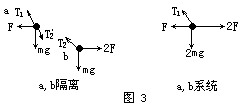
把一个带正电荷q的小球用细线悬挂在两块面积很大的竖直平行板间的O点.小球质量m=2g,悬线长L=6cm,两板间距离d=8cm.当两板间加上U=2×103V的电压时,小球自悬线水平的A点由静止开始向下运动.到达O点正下方的B点时的速度刚好为零.如图4所示.以后一直在A、B 间来回摆动.(取g=10m/s2.)
 求:
求:
(1)小球所带的电量.
(2)摆动过程中小球的最大速度.
分析及解答:
(1)取小球作研究对象.重力mg竖直向下,电场力Eq水平向左,绳的拉力T.
当小球由A向B运动过程中,重力mg对小球做正功mgL,电场力Eq对小球做负功-EqL,拉力T随时变化,但因拉力T与运动方向垂直,故不做功.因此,小球做变速运动.起初于A点时速度为零,到达B点速度又是为零.
根据动能定理∑W=△EK有:mg L-Eq L=0.
而电场强度 E=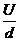
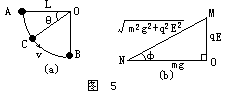 联立两式可得:q=
联立两式可得:q= =8×10
=8×10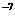 C
C
(2)设在下落角为θ的C点处小球速度达最大值v,如图5(a)所示.因在小球运动过程中,张力为变力,但此张力对小球所做的功恒等于零,故采用功能定理时可不考虑张力.
对小球自A至C的过程运用动能定理,有
mgLsinθ-qEL(1-cosθ)=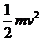
mgsinθ+qEcosθ=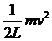 +qE
+qE
当mv2/2达极大值时,左式也达极大值.如图5(b)所示,在△MNO中,
mg=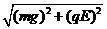 cosφ
cosφ
qE=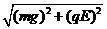 sinφ
sinφ
代入*式,则其左式变为: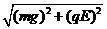 (sinθcosφ+cosθsinφ)=
(sinθcosφ+cosθsinφ)=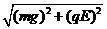 sin(θ+φ)
sin(θ+φ)
显然,当θ+φ=π/2时,左式达极大值,即∠NMO=θ=tan―1(mg/qE),代入数据,得θ=π/4;再代入上式解得:v≈0.7m/s.
(3)平行板电容器
平行板电容器的决定式C=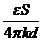
电容定义式C=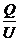
[例题3]如图7,平行板电容器充电后与电源分离,上板带负电,下板带正电且与大地相接,在两板间固定着一个负电荷(电量很小),现将电容器两板水平错开一段距离(两板间距保持不变),则 [ ]
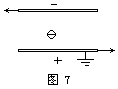 A.电容器两板间电压变大
A.电容器两板间电压变大
B.电容器两板间的场强变大
C.负电荷所在处的电势升高
D.负电荷的电势能变大
本题中电容器所带的电量Q不变,当电容器两板水平错开时,两极板的正对面积S减小;由电容决定式判知,电容器的电容C变小,再由电容定义式判知,电容器两板

由“沿电场线方向电势降低”判知,负电荷所在处的电势低于零电势,故负电荷所在处的电势Uq=-Ed',式中d'为负电荷所在处到电容器下板(即电势零点)的距离.由此式可判知,随着两板间场强E的变大,负电荷所在处的电势降低,再由“负电荷放于电势低处比放于电势高处电势能大”判知,该负电荷的电势能变大.
综上可知选项A、B、D正确.
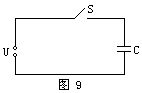 [例题4]如图9所示,把电容为C的电容器接在电压为U的电路中,讨论在下列情况下,电容器的电容、带电量和电势差的变化.
[例题4]如图9所示,把电容为C的电容器接在电压为U的电路中,讨论在下列情况下,电容器的电容、带电量和电势差的变化.
(1)接通S,使电容器的两极板间距离减为原来的一半.
(2)S接通后再断开,使电容器两极板的正对面积减为原来的一半.
首先,请同学思考,然后同桌互相交流启发,最后找两个学生将讨论过程及结果写在黑板上.
(1)U不变.由C∝1/d,且d'=d/2,故C'=2C.由C∝Q知,Q'=2Q.
(2)Q不变.由C∝S,且S'=S/2,故C'=C/2.由C∝1/U知,U'=2U.
1.以下说法中至少有一个是正确的 [ ].
A.将一电荷匀速地从电场中的A点移至B点,外力所做的功等于该电荷电势能的变化量.
B.电荷在电场中移动时,若电场力对电荷做正功,电荷的电势能一定减小,但电荷的动能不一定减小.
C.把两个异号电荷靠近时,电荷电势能增大.
D.若电场中A、B两点间的电势差为零,则同一点电荷在A、B两点所具有的电势能必定相同.
22、北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。已知:C3H8(g) = CH4(g)+HC≡CH(g)+H2(g);ΔH1=156.6 kJ·mol-1
CH3CH=CH2(g) = CH4(g)+HC=CH(g);ΔH2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g) = CH3CH=CH2(g)+H2(g)的ΔH=_____kJ·mol-1
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,CO32-移向电池的_______(填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
⑷常温下,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是_________________
21、红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。根据上图回答下列问题:
⑴P和Cl2反应生成PCl3的热化学方程式_________________________________。
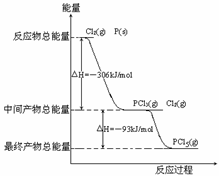 ⑵PCl5分解成PCl3和Cl2的热化学方程式_____________
⑵PCl5分解成PCl3和Cl2的热化学方程式_____________
_______________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2____α1(填“大于”、“小于”或“等于”)。
⑶工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_____________________________________。
⑷P和Cl2分两步反应生成1molPCl5的ΔH3=_________,P和Cl2一步反应生成1molPCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”)。
⑸PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________
D.奥赛一瞥
20、下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热
ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
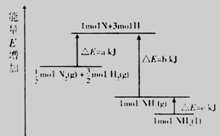
19、化学反应N2+3H2=2NH3的能量变化如右图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g)=2NH3⑴;ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);ΔH=2(b-a)kJ·mol-1
C.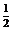 N2(g)+
N2(g)+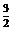 H2(g)=NH3⑴;ΔH=(b+c-a)kJ·mol-1
H2(g)=NH3⑴;ΔH=(b+c-a)kJ·mol-1
D. 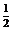 N2(g)+
N2(g)+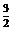 H2(g)=NH3(g);ΔH=(a+b)kJ·mol-1
H2(g)=NH3(g);ΔH=(a+b)kJ·mol-1
18、已知H2(g)、C2H4(g)和C2H5OH⑴的燃烧热分别是-285.8kJ·mol-1;-1411.0kJ·mol-1和
-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
 A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
C.-330kJ·mol-1 D.+330kJ·mlo-1
17、下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
16、已知:H2(g)+F2(g)=2HF(g)+270kJ,下列说法正确的是( )
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com