
8.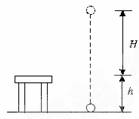 质量为m的小球,从离桌面H高处由静止下落,桌面离地面高度为h,如图所示,若以桌面为参考平面,那么小球落地时的重力势能及整个下落过程中重力势能的变化分别是
质量为m的小球,从离桌面H高处由静止下落,桌面离地面高度为h,如图所示,若以桌面为参考平面,那么小球落地时的重力势能及整个下落过程中重力势能的变化分别是
A.mgh,减少mg(H-h)
B.mgh,增加mg(H+h)
C.-mgh,增加mg(H-h)
D.-mgh,减少mg(H+h)
7.在下列几种运动中遵守机械守恒定律的是 ( )
A.雨点匀速下落 B.自由落体运动
C.汽车刹车时的运动 D.在光滑水平面上匀速运动的物体
6、质量10g、以0.80km/s飞行的子弹与质量60kg、以10m/s奔跑的运动员相比( )
A、运动员的动能较大 ; B、子弹的动能较大
C、二者的动能一样大 ; D、无法比较它们的动能
5、在光滑水平面上推物块和在粗糙水平面上推物块相比较,如果所用的水平推力相同,物块在推力作用下通过的位移相同,则推力对物块所做的功 ( )
A、一样大 ; B、在光滑水平面上推力所做的功较多
C、在粗糙水平面上推力所做的功较多; D、要由物块通过这段位移的时间决定
4、人造地球卫星在圆形轨道上环绕地球运行时有( )
A、轨道半径越大,速度越小,周期越长;
B、轨道半径越大,速度越大,周期越短
C、轨道半径越大,速度越大,周期越长 ;
D、轨道半径越小,速度越小,周期越长
3、小球做匀速圆周运动的过程中,以下各量不发生变化的是( ).
A、线速度 B、向心力 C、周期 D、向心加速度
2、关于平抛运动的性质,以下说法中正确的是 ( )
A、变加速运动; B、匀变速曲线运动;
C、匀速率曲线运动; D、不可能是两个直线运动的合运动
1.做曲线运动的物体,在运动过程中,一定变化的物理量是( )
A、速率 B、速度 C、加速度 D、合外力
0.6 /(x-1.6)=2/3,解得x=2.5(不合理,舍去)。
以此得A的分子式为CH4,B的分子式可能为C2H6、C2H4、C2H2。
例15、铁、锌合金8.5g溶于稀H2SO4中,充分反应后制得0.300gH2,求合金中Fe,Zn的含量分别为多少克。
方法:因1mol铁或锌与稀硫酸作用均产生1molH2,以此 可通过H2的物质的量求得混合物中铁锌的总物质的量,再利用十字交叉求其比例。
可通过H2的物质的量求得混合物中铁锌的总物质的量,再利用十字交叉求其比例。
捷径:先求出合金的平均摩尔质量:因Fe → H2 ,Zn → H2 ,合金→ H2,
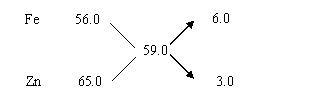 则合金的平均摩尔质量为:8.5 g /(0.300/2)mol= 59.0g/mol,平均分子量为59.0。
则合金的平均摩尔质量为:8.5 g /(0.300/2)mol= 59.0g/mol,平均分子量为59.0。
故Fe,Zn分别产生H2的物质的量之比为6.0︰3.0 = 2︰1,从而可知合金中Fe,Zn的质量分别为:
m (Fe) = 56g/mol×(0.300/2)mol×2/3 = 5.60g
m (Zn) = 65g/mol×(0.300/2)mol×1/3 = 3.25g
例16、某气体混合物含有氢气,二氧化碳和45%(体积)的氮气。它对氢气的相对密度是12.2,试求氢气和二氧化碳在混合气体中各自的体积百分含量。
方法:将氢气和二氧化碳作为一个组分,氮气作另一个组分,先求出氢气和二氧化碳这二者混合后的平均式量,而后再求组分的体积百分含量。
捷径:根据混合气对氢气的相对密度是12.2知,混合气的平均式量为22.4。
设混合气为100 L,则V(N2) = 45 L,V(H2、CO2)= 55 L。
|
|
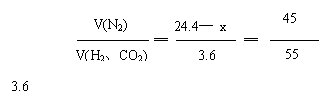
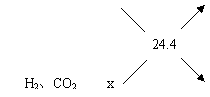
解得x=21.4

|
|


|
|
|
|
|
|




|
|
|
|
|||
|
又因为氢气和二氧化碳组分占全部混合气体的55%,所以,氢气和二氧化碳占总混合气体的体积百分数为:
V(H2)% = 55%× 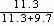 =
29.6%,V(CO2)%
=55%×
=
29.6%,V(CO2)%
=55%× 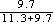 = 25.4%
= 25.4%
则全部混合气体由25.4%的CO2、29.6%的H2和45%的氮气组成。
1.8
C2H2 2 0.8
例4、 Li2CO3和BaCO3的混合物与盐酸完全反应,所消耗盐酸的量与等质量的CaCO3和同浓度的盐酸反应所消耗盐酸的量相等.则混合粉末中Li2CO3和BaCO3的质量之比为
( )
A.3:5 B.5:3 C.7:5 D.5:7
解析 首先请判 断用下列十字交叉法求出两者之比是什么量之比.
断用下列十字交叉法求出两者之比是什么量之比.

 Li2CO3
74
97
Li2CO3
74
97
100 =?
BaCO3 197 26
若设均与2 mol HCl反应,则所需的Li2CO3、BaCO3、CaCO3各1 mol,摩尔质量分别为74g/mol、197g/mol、100g/mol.故上面用十字交叉法求出的是Li2CO3和BaCO3的物质的量之比.然 后换算为质量比.
后换算为质量比.
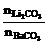 =
= Þ
Þ 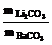 =
=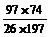 =
= .
.
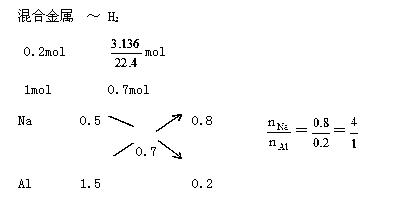
例5、 Na、Al混合物0.2 mol溶于足量盐酸,产生H2 3.136mL(S.T.P),求Na、Al的物质的量之比.
解析 Na - 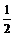 H2 Al -
H2 Al - 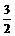 H2
H2
1mol 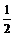 mol 1mol
mol 1mol 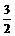 mol
mol
例6、原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”。
(1)已知铱的一种同位素是19177Ir,则其核内的中子数是 ( ) A.77 B.114 C.191 D.268 (2)已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比应为 ( ) A.39︰61 B.61︰39 C.1︰1 D.39︰11
方法:(1)可利用“质量数=质子数+中子数”求解,(2)利用“十字交叉”求解。
捷径:(1)根据“质量数=质子数+中子数”知:中子数=191-77=114。选B。
(1) 利用“十字交叉”可得:

以此19177Ir与19377Ir两种同位素的原子个数比为:0.78︰1.22=39︰61,得答案为A。
例7、由CO2、H2、和CO组成的混合气在同温同压下与氮气的密度 相同。则该混合气中CO2、H2、和CO的体积比为 ( )
相同。则该混合气中CO2、H2、和CO的体积比为 ( )
A.29︰8︰13 B.22︰1︰14 C.13︰8︰29 D.26︰16︰57
方法:将题中三种气体的式量与氮气的式量作比较,找出其间的联系,然后用“十字交叉”求解。
捷径:由于CO在同温同压下时的密度与N2相同,所以CO的含量为任意值。只要CO2与H2的混合气体密度等于N2,即平均相对分子质量等于28便满足题意。利用“十字交叉”可求得CO2与H2的体积比,即:
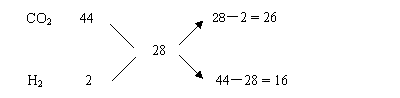
只要在在同温同压下混合气中CO2与H2的体积比满足26︰16或13︰8即 可。以此得答案为CD。
可。以此得答案为CD。
例8、已知Fe2O3在高炉中有下列反应:Fe2O3+CO→2FeO+CO2,反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用 mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是 (选填 a、b、c多选扣分)
(a)21︰9 (b)21︰7.5 (c) 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率
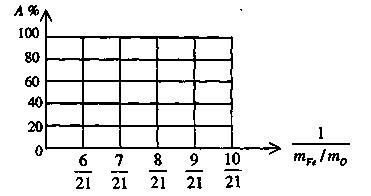
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。
A%=
请在下图中画出A%和mFe/mO关系的图形。
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2 ,Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
|
混和物组成(用化学式表示) |
a的取值范围 |
|
|
|
方法:利用十字交叉及数形结合方法解题。
捷径:(1)Fe2O3中mFe︰mO=(56×2)︰(16×3)=21︰9,在FeO中mFe︰mO=56︰16=7︰2,在Fe2O3和FeO的混合物中,mFe︰mO应介于21︰9 ~ 21︰6之间,所以不可能是21︰9或21︰6 。故选a、c。
(2)解法一:因为Fe2O3中mFe︰mO=21︰9,FeO中mFe︰mO =21︰6,在混合物中
=21︰6,在混合物中
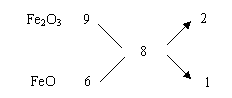
Fe2O3与FeO物质的量之比可通过十字交叉确定为:
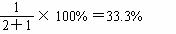
被还原Fe2O3的百分率为:
解法二:设原有Fe2O3物质的量为 1 mol,还原率为 A%,则混合物中有(1-A%)molFe2O3和2A% mol的Fe 。
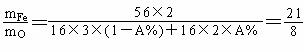
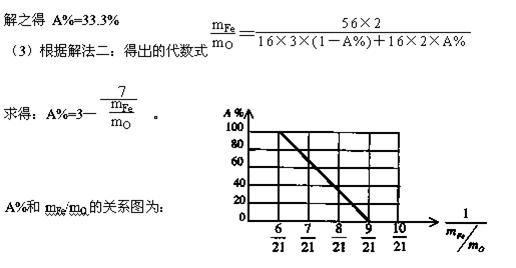
(4)可能组成的混合物是Fe2O3、Fe3O4,Fe3O4、FeO,Fe2O3、Fe3O4、FeO,其中Fe3O4中mFe︰mO =(56×3)︰(16×4)=21︰8,所以有:当混合物是Fe2O3、Fe3O4时,8<a< 9,当混合物是Fe3
=(56×3)︰(16×4)=21︰8,所以有:当混合物是Fe2O3、Fe3O4时,8<a< 9,当混合物是Fe3 O4、FeO时6<a< 8,当混合物是Fe
O4、FeO时6<a< 8,当混合物是Fe 2O3、Fe3O4、FeO时6<a<9 。
2O3、Fe3O4、FeO时6<a<9 。
例9、有四种不纯的碳酸钠样品 ,分别含有下列选项中的一种杂质。取等质量的样品,分别向这些样品中加入2mol/L盐酸,均完全反应生成CO2,且所耗盐酸的体积也均相同。这四种样品中Na2CO3的质量百分比最小的是( )
,分别含有下列选项中的一种杂质。取等质量的样品,分别向这些样品中加入2mol/L盐酸,均完全反应生成CO2,且所耗盐酸的体积也均相同。这四种样品中Na2CO3的质量百分比最小的是( )
A.KHCO3 B.NH4HCO3 C.K2CO3 D.NaHCO3
方法:将四种杂质中不是正盐的都看作“正盐”,然后与Na2CO3比 较,通过十字交叉分析求解。
较,通过十字交叉分析求解。
捷径:将四种杂质都看作“正盐”--假设与Na2CO3相当,“1mol”盐消耗2mol盐酸,则(A)(B)(C) (D)的“分子量”依次变为200、158、138和168。各组混合物耗酸量相同时,各组盐的物质的量n正盐必相等。又因为各组盐的质量相同,所以盐的平均分子量相同。这样,Na2CO3与所含杂质物质的量之比则可由下式计算:
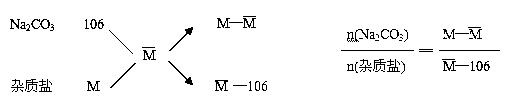
欲使Na2CO3的含量最小,上式中M(即换量后杂质盐的分子量)值就应最小。M(K2CO3)=138,最小。故答案为C。
例10、甲烷和丙烷混合气的密度与同温同压下乙烷密度相同,混合气中甲烷与丙烷的体积比是( )
A.2︰1 B.3︰1 C.1︰3 D.1︰1
方法:通过平均分子量和十字交叉求算。
捷径:因混合气的密度与同温同压下乙烷密度相同,故混合气的平均分子量也与乙烷的分子量相同,即为30,又甲烷的分子量16,丙烷的分子量44。利用十字交叉得:

相同条件下,1︰1既是体积比又是物质的量比,因此选D 。
例11、已知下列两个热化学方程式
2H2(g)+ O2(g)= 2H2O(l);△H=-571.6kJ/mol
C3H8(g)+ 5O2(g)= 3CO2(g)+4H2O(l);△H=-2220 kJ/mol
实验测得氢气和丙烷气体共5mol完全燃烧放热3847kJ,则混合气体中氢气与丙烷的体积比是( )
A.1︰3 B.3︰1 C.1︰4 D.1︰1
方法:首先求得混合气体1mol完全燃烧所放出的热量,再通过十字交叉求其比例。
捷径:氢气和丙烷气体共5mol完全燃烧放热3847kJ,则1mol混合气体所放出的热量为769.4kJ。根据十字交叉求得其比例为:

以此得答案为B。
例12、把100g 10%KNO3溶液的浓度增加到20%,可采用的方法是
A.蒸发掉45g水 B.蒸发掉50g水
C.加入10g KNO3固体 D.加入15g KNO3固体
方法:采取去水或加硝酸钾两种方法,利用十字交叉分别求算。
捷径:①去水加浓。(水的“浓度”视为零)。

上式的意义是20g10%的溶液去掉(负号表示)10g水即可得20%的溶液,所以100g10%的溶液需去水10/20×100=50(g),选B 。
 ②加KNO3(KNO3“浓度”视为100%),有
②加KNO3(KNO3“浓度”视为100%),有
需加KNO3  × 100 = 12.5(g),C、D都不能选。
× 100 = 12.5(g),C、D都不能选。
本题答案只能是B。
例13、常温下,一种烷烃A和一种单烯烃B组成混合气。A或B分子中最多只含4个碳原子,且B分子的碳原子数比A分子多。将1 L该混合气充分燃烧,在同温同压下得2.5 LCO2气体,推断原混合气中A和B所有可能的组合及其体积比。
方法:先根据混合气的平均碳原子数2.5确定可能的组合,再利用十字交叉求解。
捷径:据题意,1mol混合烃含碳2.5mol,且B的碳原子数多于A,可能的混合气组成只能是下面4种
A B
① CH4 C3H6
② CH4 C4H8
③ C2H6 C3H6
④ C2H6 C4H8
运用十字交叉法(根据碳原子数列式),有:
①
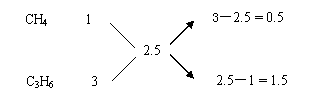 CH4、C3H6组成混合气时
CH4、C3H6组成混合气时
上式表明,混合时A和B的体积比为1︰3(即0.5︰1.5)。
②、③、④种组合时A与B的体积比也都可按上法求出,答案分别为1︰1,1︰1,3︰1,具体过程不再重复。
例14、某气态烃A和B按2︰3(体积比)混合后,取0.1mol与一定量氧气混合燃烧,产物为CO、CO2和水蒸气。将燃烧产物依次通过足量的浓硫酸、灼热的CuO及碱石灰,最后碱石灰增重7.04g。求A和B可能的分子式。
方法:根据碱石灰增重即为CO2的质量,求得烃的平均碳原子数,再结合气态烃A和B体积比为2︰3和十字交叉法求得结果。
捷径:(1)碱石灰吸收的CO2包括燃烧生成的CO2及CO转化(还原CuO)成的CO2,即0.1mol混合烃中的C转化成CO2的总量,共为7.04g÷44g/mol=0.16mol 。
可知:1mol混合烃含碳1.6mol,所以混合烃一定含CH4。
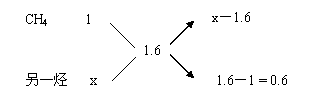 (2)设另一烃分子中含x个碳原子:
(2)设另一烃分子中含x个碳原子:
① 令A为CH4,则有
(x-1.6)/ 0.6 = 2/3,解得x=2
B可能是C2H6、C2H4、C2H2。
② 令B为CH4,则有
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com