
2. 2008年,《奇迹天工-中国古代发明创造文物展》在中国科技馆新馆开展,新“四大发明”首次集体亮相。其中被誉为“出现最早、应用最广、传播最远、技术最高”的发明应该是
A. 瓷器 B.丝绸 C.青铜 D.酿酒
1. 苏轼曾经指出:“民庶之家,置庄田,招佃客,本望租课非行仁义,然犹至水旱之岁,必须放免欠负、贷借种粮者,其心诚恐客散而田荒,后日之失必倍于今故也。”苏轼的这句话反映出的主要问题是
A. 宋代时期,地主依靠土地剥削来积累财富
B. 宋代地主具有开展民间赈济的社会责任感
C.宋代佃户租种土地有较大的选择权和自由度
D.从宋代开始农村出现以租佃关系进行土地经营
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ →Cu + Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。 ;
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是
他们进行了如下实验:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉
末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量
为72g。据此可推得,A的化学式为 。由此,得到的结论是 。
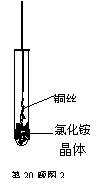 (四)兴趣探究
(四)兴趣探究
将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒
精灯上将该铜丝加热至红热状态。如右图所示,趁热插入到试管里的
氯化铵晶体中,在试管中出现白烟。冷却后取出铜丝变成亮红色。
(1)试管中出现白烟的有关化学方程式为 。
(2)铜丝灼热后在氯化铵中由黑变红的有关化学方程式 。
(二)实验探究
该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气
的还原性:

该装置在设计上有一定缺陷,可以采取的的改进措施是 。
利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的N2。
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)在实验室中,还可以用浓氨水与 (填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。
你认为他能否达到目的? (填“能”或“否”),理由是 。
17.(9分)
某反应中反应物与生成物有:AsH3
、H2SO4 、KBrO3 、K2SO4
、H3AsO4 、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应被还原的元素是 ,还原剂是 。
(2)已知0.2mol KBrO3在反应中生成X时得到 1 mol电子,则X的电子式为 。
 (3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
(4)根据上述反应可推知
(填字母序号)。
a.氧化性:KBrO3 >
H3AsO4 b.氧化性:H2SO4
> KBrO3
c.还原性:AsH3 > X d.还原性: X > AsH3
18.(15分)
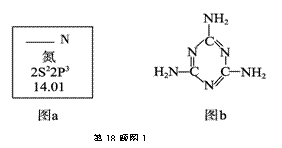 氮元素是生命活动、物质间转化的常见元素。
氮元素是生命活动、物质间转化的常见元素。

(1)图a是元素周期表中N元素的有关信息,图a中横线上缺失的具体内容是 。
15N是N元素的一种重要核素,其一个原子核中含有的中子数为 。
(2)三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,正确的
是 (填字母序号)。
A.三聚氰胺的熔点可能很高 B.三聚氰胺的含氮量高达67%左右
C.三聚氰胺属于无机化合物 D.三聚氰胺分子中所有原子在同一平面上
(3)H与N能形成化合物NH5 ,已知该物质与水反应有H2生成,则NH5中含有的化学键除了极性键还有 ,该反应的化学方程式为 。
(4)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为
35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。有关物质间的转化关系如下图所示。

①写出D与X反应的化学方程式 。
②写出G与H反应的离子方程式 。
③实验室中I应如何保存? 。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出
M分解的热化学方程式 。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
19.(13分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属
被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。21世纪是钛的世纪。下面
是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:

已知: Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1 试回答下列问题:
(1)Ti元素的基态原子的核外电子排布式为 ;
(2)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
TiO2+发生水解的离子方程式为 。
(3)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ;反应Ⅱ的热化学方程式为 。
(4)该工艺流程中,可以循环使用的物质有 。
(5)在800℃-1000℃时电解TiO2也可制得海绵钛,装置如下图所示。

图中b是电源的 极,阴极的电极反应式为 。
20.(15分)
某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
16.某同学为监察溶液中是否含有常见的四种离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是 ( )






A.原溶液中一定含有SO42-
离子 
B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 
D.原溶液中一定含有Fe3+离子
第Ⅱ卷 (非选择题 共52分)
15.下列实验不能先用蒸馏水润湿试纸的是
( )
A.用品红试纸检验SO2
B.用淀粉碘化钾试纸检验Cl2
C.用红色石蕊纸检验NH3
D.用pH试纸测定某溶液的pH值
14.根据以下事实得出的判断一定正确的是
( )
A.HA的酸性比HB的强,则HA溶液的 pH一定比HB溶液的小
B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
C.同温下 ,A盐溶解度比B盐大,则A盐溶液的物质的量浓度比B盐溶液的大
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
13.在标准状况下,进行甲、乙、丙三组实验:三组各取60mL 同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下: 
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |
则下列说法正确的是
( )
A.甲组和乙组的实验中,盐酸均是过量的 
B.盐酸的物质的量浓度为0.8 mol·L―1 
C.合金中镁铝的物质的量之比为1∶1 
D.丙组中铝的物质的量为0.009 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com