
2.稠环芳烃两个或两个以上的苯环分别共用两个相邻的碳原子而成的芳烃。如萘、蒽、菲

蒽和菲互为同分异构体。
1.单环芳烃分子中只含一个苯环的芳烃。如苯、甲苯、二甲苯等。
3.隔离双键二烯烃两个双键被两个以上单键隔开的二烯烃。如1,4-己二烯(CH2=CH-CH2-CH=CH-CH3)。在二烯烃中,共轭双键二烯烃是最重要的一类,其中丁二烯和异戊二烯是合成橡胶的重要原料。
1,3-丁二烯的性质
在常温和常压下,1,3-丁二烯是无色而略带大蒜味的可燃气体。沸点-4.41℃,熔点-108.9℃。有毒,空气中含低浓度时,对粘膜有刺激性,高浓度有麻醉作用。与空气能形成爆炸混合物,爆炸极限2.16-11.47%(体积)。1,3-丁二烯微溶于水,易溶于苯、乙醚、氯仿、四氯化碳、汽油等有机溶剂。1,3-丁二烯的化学性质活泼,可使酸性KMnO4溶液或溴水褪色,更重要的是能发生加聚反应(自身1,4加成),化学方程式为:

这是用共轭二烯烃及其衍生物制造合成橡胶的反应基础。
乙炔的结构
乙炔分子里碳碳叁键的键能是812千焦/摩,比三个碳碳单键的键能之和要小得多(也比一个单键和一个双键键能之和小)。叁键的键长是1.20×10-10米,比单键或双键的键长都短。乙炔分子里C≡C键跟C--H键间的夹角是180°,即乙炔分子里的两个碳原子和两个氢原子处在一条直线上。乙炔分子里每个碳原子,是以一个2s轨道和一个2p轨道进行杂化,形成两个能量相等的sp杂化轨道。这两个sp杂化轨道的对称轴在同一条直线上。每个碳原子各以一个sp杂化轨道跟氢原子的一个1s轨道进行重叠而形成一个碳氢的σ键。同时又各以其另一个sp杂化轨道相互重叠形成一个碳碳的σ键。在两个碳原子里还各有另外两个p轨道没有参加杂化,它们的电子云互相垂直,同时也跟碳碳间σ键的对称轴垂直。这样就在4个p电子之间形成两个π键,这两个π键是互相垂直的。乙炔分子里的C≡C叁键是由一个σ键和两个相互垂直的π键所组成。已知π键的键能小于σ的键能,所以在一定条件下,π键容易断裂,容易发生氧化反应、加成反应等。

炔 烃
分子里含一个碳碳叁键的链烃。炔烃的组成通式为CnH2n-2。炔烃与碳原子数目相同的二烯烃互为同分异构体。炔烃分子中的碳碳叁键是官能团,性质活泼,容易发生氧化反应、加成反应和加聚反应。炔烃里最简单的是乙炔。乙炔在氧气中燃烧产生高达3500℃高温,用于金属的焊接或切割,大量的乙炔用为化工原料制聚氯乙烯、氯丁橡胶及醋酸等。实验室小量制乙炔,常用电石跟水反应排水收集。工业上用天然气中甲烷的部分氧化或石油高温裂解而得
芳香烃
分子中含有一个或多个苯环的烃类,简称芳烃。根据它们的结构,可分为三类:
2.共轭双键二烯烃两个双键被一个单键隔开的二烯烃。如1,3-丁二烯,1,3-戊二烯和异戊二烯。共轭二烯烃除具有和烯烃相似的化学性质外,主要特点是能发生1,4加成、聚合反应。
1.聚集双键二烯烃如丙二烯CH2=C=CH2。这是一种无色气体,加热时,异构化成丙炔。
4.如含有几个相同的取代基,则在取代基的前面用中文数字二、三、四等表明相同基的数目;如取代基不同,就把简单的写在前面,复杂的写在后面。如:

环烷烃
组成烃分子的碳原子相互连接成环状的,叫环烃,在环烃分子中,碳原子之间全是单键相互结合的叫环烷烃,也叫饱和脂环烃。由三个、四个碳原子组成的环烷烃,环的稳定性较差,在一些试剂的作用下易发生开环反应。五个以上碳原子构成的环较稳定。这些环烷烃的性质与饱和链烃相似。以下是几种环烷烃的结构简式:
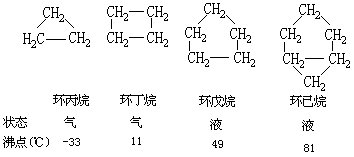
环烷烃的通式为CnH2n,它们与相应的烯烃属同分异构体。在环烷烃中,目前使用较多的是环己烷,常用为树脂的有机溶剂以及制尼龙-6的原料。
不饱和烃
分子中含双键或叁键的烃。有双键的称烯烃(一个双键)或二烯烃(两个双键),有叁键的称炔烃。如:
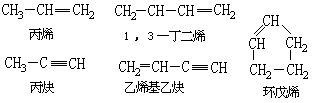
不饱和烃的化学性质活泼,易受酸性KMnO4溶液氧化,易发生加成反应和加聚反应。
加成反应
有机物分子中的双键或叁键发生断裂,加进(结合)其它原子或原子团的反应。如
CH2  CH2+Br2→CH2Br-CH2Br
CH2+Br2→CH2Br-CH2Br
CH  CH+H2
CH+H2  CH2
CH2 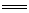 CH2
CH2
醛羰基和酮羰基的双键与烯烃的碳碳双键一样,其中一个键易断裂而发生加成反应,如:
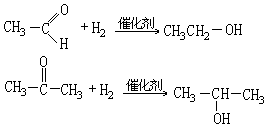
如加成试剂为简单化合物时,分子中带正电性的原子加到羰基带负电性的氧原子上,带负电性的原子(或原子团)加到羰基的碳原子上,如:
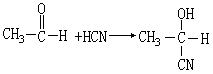
用结构简式表示加成反应时,不饱和化合物一定变得相对饱和,并且两个不饱和碳原子要分别结合某种原子或原子团。如:

此外,丙烯的结构简式,其中双键须表示出来,应写为CH3-CH==CH2,不能写成CH3CHCH2。
加聚反应
小分子的烯烃或烯烃的取代衍生物在加热和催化剂作用下,通过加成反应结合成高分子化合物的反应,叫做加成聚合反应,简称加聚反应。如:
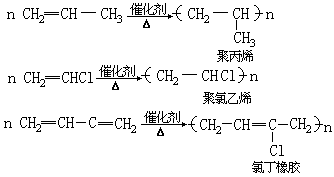
单体可以是两种以上的不同物质,如:
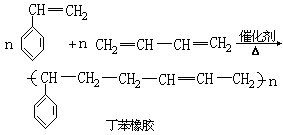
在工业上,通过加聚反应制造合成塑料、合成橡胶等。
高分子
高分子化合物的简称。高分子的分子量从几千到几十万甚至几百万,所含原子数目一般在几万以上,而且这些原子是通过共价键连接起来的。高分子化合物由于分子量很大,分子间作用力的情况与小分子大不相同,从而具有特有的高强度、高韧性、高弹性等。高分子化合物中的原子连接成很长的线状分子时,叫线型高分子(如聚乙烯的分子)。这种高分子在加热时可以熔融,在适当的溶剂中可以溶解。高分子化合物中的原子连接成线状但带有较长分支时,也可以在加热时熔融,在适当溶剂中溶解。如果高分子化合物中的原子连接成网状时,这种高分子由于一般都不是平面结构而是立体结构,所以也叫体型高分子。体型高分子加热时不能熔融,只能变软;不能在任何溶剂中溶解,只能在某些溶剂中溶胀。高分子化合物在自然界中大量存在,这种高分子叫天然高分子。在生物界中,构成生物体的蛋白质,纤维素;携带生物遗传信息的核酸;食物中的淀粉,衣服原料的棉、毛、丝、麻以及木材、橡胶等等,都是天然高分子。非生物界中,如长石、石英、金刚石等,都是无机高分子。天然高分子可以通过化学加工成天然高分子的衍生物,从而改变其加工性能和使用性能。例如,硝酸纤维素、硫化橡胶等。完全由人工方法合成的高分子,在高分子科学中占有重要的地位。这种高分子是由一种或几种小分子作原料,通过加聚反应或缩聚反应生成的,故也叫聚合物。用做原料的小分子称为单体,如由乙烯(单体)经加聚反应得聚乙烯(聚合物);由乙二醇(单体)和对苯二甲酸(单体)经缩聚反应生成聚对苯二甲酸乙二酯(聚合物)。

乙烯的结构
实验表明,乙烯分子里的C=C双键的键长是1.33×10-10米,乙烯分子里的2个碳原子和4个氢原子都处在同一个平面上。它们彼此之间的键角约为120°。乙烯双键的键能是615千焦/摩,实验测得乙烷C-C单键的键长是1.54×10-10米,键能348千焦/摩。这表明C=C双键的键能并不是C-C单键键能的两倍,而是比两倍略少。因此,只需要较少的能量,就能使双键里的一个键断裂。这是乙烯的性质活泼,容易发生加成反应等的原因。
在形成乙烯分子的过程中,每个碳原子以1个2s轨道和2个2p轨道杂化形成3个等同的sp2杂化轨道而成键。这3个sp2杂化轨道在同一平面里,互成120°夹角。因此,在乙烯分子里形成5个σ键,其中4个是C-H键(sp2-s)1个是C-C键(sp2-sp2);两个碳原子剩下未参加杂化的2个平行的p轨道在侧面发生重叠,形成另一种化学键:π键,并和σ键所在的平面垂直。如:乙烯分子里的C=C双键是由一个σ键和一个π键形成的。这两种键的轨道重叠程度是不同的。π键是由p轨道从侧面重叠形成的,重叠程度比σ键从正面重叠要小,所以π键不如σ键牢固,比较容易断裂,断裂时需要的能量也较少。

烯 烃
是指分子中含一个碳碳双键的链烃。通式为CnH2n。与碳原子数目相同的环烷烃互为同分异构体。C2-C4的烯烃在常温常压下是气体,C5-C15的烯烃是液体,分子中含碳原子数更多的烯烃是固体。都可燃,火焰明亮。它们的物理性质,一般地随分子中碳原子数目增加而有规律地变化。烯烃分子中因含有双键,化学性质比烷烃活泼,容易发生氧化反应、加成反应和加聚反应等。从工业生产角度说,重要的是乙烯和丙烯,它们是制造合成纤维、合成树脂等的基础原料,工业上是由石油裂解生产的。
二烯烃
是分子中含两个双键的不饱和烃。按分子结构,有环状二烯烃(如1,3-环戊二烯)和链状二烯烃。通常,二烯烃是指分子中含两个双键的不饱和链烃。二烯烃分子中,由于两个双键的位置不同,有三种情况:
3.把取代基的名称写在烷烃名称前面,在取代基的前面用阿拉伯数字注明它在烷烃直链上的位置,并在号数后面连一短线。如:
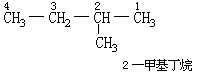
2.由距离支链最近的一端开始,将主链上的碳原子用1,2,3……,等数字依次编号,以确定支链的位置。如:
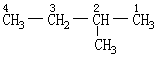
1.从结构中选定最长的碳链为主链,根据这个碳链所含碳原子数称为“某”烷,并以它作母体。将主链以外的其它烷基看作取代基(或称支链)。但初学者容易出现的错误是习惯于把横向排列的碳链作为主链,其它作为支链。如:

误认为主链含4个碳原子,而实际是5个碳原子。
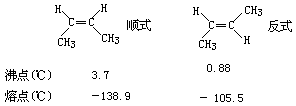
4.立体异构具有相同分子式的化合物中,由于原子或原子团在空间排列不同而引起的同分异构现象。有几何异构(也称顺反异构)和旋光异构(从略)。由于双键或环的存在,某些原子或原子团在空间的排列不同而产生几何异构。如:2-丁烯
烷烃的命名
1892年日内瓦国际化学会议规定了一个命名原则,这个命名原则称为日内瓦命名法,也称国际命名法。我国的有机化合物命名原则是根据我国的文字特点,参照国际命名法制定的,称为系统命名法。烷烃的系统命名法如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com