
3.氧化又称油脂的酸败。油脂贮存过久就会变质,颜色变深,产生一种特殊气味,俗称“哈喇”,化学上称为“油脂的酸败”。主要是空气中的氧及细菌的作用,使油脂氧化、分解生成有特殊气味的低级醛、酮、羧酸等。因此油脂要贮存在干燥避光的密闭容器中,并存放于阴凉处,贮存期也不宜过久。
油脂的用途
是人类的重要食物之一,也是重要的化工原料。用于制造肥皂、脂肪酸、甘油、油漆、油墨、乳化剂、润滑剂等,还用于医药、化妆品制造(参看油脂的性质)。
肥 皂
是高级脂肪酸盐(钠盐、钾盐、铵盐)的总称。肥皂中除含高级脂肪酸盐外,还含有松香、水玻璃、香料、染料等填充剂。从结构上看,在高级脂肪酸钠的分子中含有非极性的憎水部分(烃基)和极性的亲水部分(羧基)。憎水基具有亲油的性能。在洗涤时,污垢中的油脂被搅动、分散成细小的油滴,与肥皂接触后,高级脂肪酸钠分子的憎水基(烃基)就插入油滴内,靠范德华力与油脂分子结合在一起。而易溶于水的亲水基(羧基)部分伸在油滴外面,插入水中。这样油滴就被肥皂分子包围起来,分散并悬浮于水中形成乳浊液,再经摩擦振动,就随水漂洗而去,这就是肥皂去污原理。但普通肥皂不宜在硬水或酸性水中使用。在硬水中因生成难溶于水的硬脂酸钙盐和镁盐,在酸性水中生成难溶于水的脂肪酸,大大降低其去污能力。

合成洗涤剂
又称合成表面活性剂,是根据肥皂的分子结构和去污原理,人工合成的一系列与肥皂分子相类似结构的化合物,它们的分子中同时含有亲水基团和憎水基团,能降低水的表面张力,是一种表面活性剂,根据不同的用途,可作洗涤剂、乳化剂、分散剂、润滑剂和起泡剂(十二烷基磺酸钠就是牙膏中的起泡剂)。我国目前大量生产的合成洗涤剂是烷基苯磺酸钠或烷基磺酸钠,它们的结构如下:

其中的亲水基团是强极性的磺酸基-SO3Na,憎水基团是非极性的烃基,式中的R-一般是含十个碳以上的直链烷烃基。当R含碳原子太小时憎水亲油作用弱,去油污能力不强。当R含碳原子太多时,在水中的溶解度会下降。常用洗衣粉中的主要成分为十二烷基苯磺酸钠。合成洗涤剂比肥皂有更强的去污能力,而且浸润、乳化能力都很强,其钙盐、镁盐都可溶,不受硬水影响,在盐水和酸溶液中也不分解。因此,合成洗涤剂的生产发展迅速,除作家庭洗涤剂外,还广泛用于纺织、印染、制革、选矿、金属加工及化妆品等工业部门。它们以石油产品为原料,通过以下反应制备。


塑 料
是三大合成材料中品种最多、产量最大的一类合成高分子材料。塑料是具有可塑性的高聚物,在一定温度、压强下能形成规定形状,当降温和解除压力后,仍能保持成型的形状。根据受热表现的特性,分为热塑性和热固性两大类。热塑性塑料受热时可软化变形,可以多次反复塑化成型,如聚乙烯、聚氯乙烯等。从结构上看它们都属于线型高分子化合物。热固性塑料成型后加热不软化,不能反复加工成型,其次品和废品不能回收利用,如酚醛树脂、环氧树脂等,它们都是体型高分子化合物(空间网状结构)。塑料制品具有质轻、绝缘、耐腐蚀、耐磨、易加工、美观等优点,是飞机、汽车、机械、化工、建筑、电器用品和日用品工业的重要原材料。塑料中的“四烯”(聚乙烯、聚氯乙烯、聚丙烯、聚苯乙烯)用途非常广泛,称通用塑料。另一类是具有金属的刚性和韧性,能承受一定的外力作用,抗冲击强度高,有良好的机械性能的塑料,称工程塑料。如聚酰胺1010,聚碳酸酯、聚甲醛、ABS工程塑料等。
合成纤维
是化学纤维的一种。以小分子的有机化合物为原料,经加聚反应或缩聚反应合成的线型有机高分子化合物,如聚丙烯腈、聚酯、聚酰胺等。从纤维的分类可以看出它属于化学纤维的一个类别。

合成纤维的主要品种如下:(1)按主链结构可分碳链合成纤维,如聚丙烯纤维(丙纶)、聚丙烯腈纤维(腈纶)、聚乙烯醇缩甲醛纤维(维尼纶);杂链合成纤维,如聚酰胺纤维(锦纶)、聚对苯二甲酸乙二酯(涤纶)等。(2)按性能功用可分耐高温纤维,如聚苯咪唑纤维;耐高温腐蚀纤维,如聚四氟乙烯;高强度纤维,如聚对苯二甲酰对苯二胺;耐辐射纤维,如聚酰亚胺纤维;还有阻燃纤维、高分子光导纤维等。合成纤维的生产有三大工序:合成聚合物制备、纺丝成型、后处理。
合成橡胶
是人工合成的高弹性聚合物,以煤、石油、天然气为原料,便宜易得,而且品种很多,并可按工业、公交运输的需要合成各种具有特殊性能(如耐热、耐寒、耐磨、耐油、耐腐蚀等)的橡胶,因此目前世界上合成橡胶的总产量已远远超过了天然橡胶。合成橡胶主要有顺丁橡胶、丁苯橡胶、氯丁橡胶、丁腈橡胶等。按橡胶制品形成过程可分热塑性橡胶和硫化型橡胶;按成品状态可分为液体橡胶、固体橡胶、粉末橡胶和胶乳。合成的生胶具有良好的弹性,但强度不够,必须经过加工才能使用,其加工过程包括塑炼、混炼、成型、硫化等步骤。我国的橡胶工业起步较晚,1949年全国耗胶量仅为13000吨,国内自产天然橡胶仅200吨。50年代初期开始研制合成橡胶,1958年首先在四川建成氯丁橡胶的工业生产装置,1959年在兰州建成万吨级丁苯橡胶装置,1960年后建成顺丁橡胶装置,1971年后先后在北京、上海等地建成大型、特种橡胶生产装置。1984年我国耗胶量已达610000吨,居世界第四位,其中34.4%为合成橡胶。
糖 类
是自然界广泛存在的一类有机化合物。从结构特点看,它们是多羟基醛、多羟基酮及其缩聚产物。多数糖类的分子组成符合通式Cm(H2O)n,如葡萄糖(C6H12O6)、核糖(C5H10O5)、蔗糖(C12H22O11)等,故最早称为碳水化合物。但也有例外,如鼠李糖(C6H12O5),脱氧核糖(C5H10O4)。另有一些分子式符合Cm(H2O)n的有机物,如甲醛(CH2O)、乙酸(C2H4O2)、甲酸甲酯(C2H4O2)等并不属于糖类。糖类根据它能否水解和水解后生成的产物,可分三类:单糖、低聚糖、多糖(参看各相应条)。糖类是植物和某些微生物以二氧化碳和水为原料,在日光作用下经过一系列复杂过程合成的,可概括为:

它们在动植物内的代谢作用中氧化成二氧化碳和水,同时放出能量:
Cx(H2O)y+xO2→xCO2+yH2O+能量
因此它们是生物体维持生命活动所需要的主要能源,也是机体中合成其它有机物的原料。
单糖和多糖
它们是糖类化合物的主要类别。(l)单糖一不能水解的最简单的糖,根据其分子中碳原子数为三、四、五、六……,分别叫丙、丁、戊、己糖,如葡萄糖、果糖(C6H12O6)为己糖,核糖(C5H10O5)为戊糖。其中按结构可分为醛糖(葡萄糖、核糖)和酮糖(果糖)。单糖具有醛或酮的通性,也具有醇的通性,单糖都具有还原性,均可发生银镜反应并与新制氢氧化铜悬浊液反应。单糖都是有甜味的无色晶体。(2)双糖--是由两分子单糖缩合而成的有机物,水解后生成两分子单糖,是最常见的低聚糖(又称二糖)。其中最重要的有蔗糖、麦芽糖(C12H22O11),它们互为同分异构体。它们都是有甜味的无色晶体,其区别是麦芽糖有还原性而蔗糖没有。(3)多糖--由许多单糖缩聚而成的高聚物,水解后可以得到许多单糖。多糖的分子质量不固定,一种多糖的相对分子质量有一定范围。多糖是非晶体,不溶(纤维素)或只溶于热水(淀粉),没有甜味,没有还原性。重要的多糖有淀粉和纤维素,它们的分子通式为(C6H10O5)n。
果 糖
是己酮糖,分子式C6H12O6,存在于水果和蜂蜜中,纯净果糖是白色晶体,易溶于水,是最甜的糖。结构式如下图。它和葡萄糖互为同分异构体。果糖分子中没有醛基,但酮羰基邻位有羟基存在,其水溶液也能发生银镜反应,也能被新制氢氧化铜氧化,生成氧化亚铜红色沉淀,具有还原性,反应结果分子中碳链断裂。果糖是一种重要的营养剂,还可作药用。蔗糖水解可得果糖和葡萄糖:

葡萄糖的性质
是己醛糖,分子式C6H12O6,白色晶体,易溶于水,熔点146℃,它的结构式如下图:它是自然界分布最广泛的单糖。其主要化学性质是:(1)分子中有醛基,有还原性,能与银氨溶液反应,被氧化成葡萄糖酸:

还能与新制Cu(OH)2悬浊液反应:

(2)醛基还能被还原为己六醇:

(3)分子中有多个羟基,能与酸发生酯化反应,如实验室常用乙酰氯

(4)葡萄糖在生物体内发生氧化反应,放出热量。
C6H12O6(固)+6O2(气)→6CO2(气)+6H2O(液)+2804千焦
葡萄糖的性质
是己醛糖,分子式C6H12O6,白色晶体,易溶于水,熔点146℃,它的结构式如下图:它是自然界分布最广泛的单糖。其主要化学性质是:(1)分子中有醛基,有还原性,能与银氨溶液反应,被氧化成葡萄糖酸:

还能与新制Cu(OH)2悬浊液反应:

(2)醛基还能被还原为己六醇:

(3)分子中有多个羟基,能与酸发生酯化反应,如实验室常用乙酰氯

(4)葡萄糖在生物体内发生氧化反应,放出热量。
C6H12O6(固)+6O2(气)→6CO2(气)+6H2O(液)+2804千焦
葡萄糖的用途
是生物体内新陈代谢不可缺少的营养物质。它的氧化反应放出的热量是人类生命活动所需能量的重要来源。在食品、医药工业上可直接使用,在印染制革工业中作还原剂,在制镜工业和热水瓶胆镀银工艺中常用葡萄糖作还原剂。工业上还大量用葡萄糖为原料合成维生素C(抗坏血酸)。

核 糖
一种戊醛糖,分子式C5H10O5,是在细胞中发现的,是细胞核的重要组成部分,是人类生命活动中不可缺少的物质。它具有醛糖的通性(参看葡萄糖的性质)、它是核糖核酸(RNA)的重要组成部分,其结构式为:

另一种重要的核糖是脱氧核糖,分子式C5H10O4,是分子中氢原子数和氧原子数不符合2∶1的一种戊醛糖,它是脱氧核糖核酸(DNA)的重要组成部分,其结构式为:

淀粉的性质
淀粉是一种多糖,分子式为(C6H10O5)n,是白色颗粒状的固体,其颗粒大小,形状及水溶性因其来源和结构不同而异。绿豆淀粉主要是分子量较小的直链淀粉,可溶于热水形成胶体,与碘作用形成深蓝色配合物;糯米淀粉主要是分子量较大的支链淀粉,不溶于热水,但在热水中溶胀而有粘性,与碘作用形成紫色的配合物;一般淀粉因两种结构兼而有之,故遇碘呈蓝紫色。淀粉没有还原性,不能被银氨溶液与新制氢氧代铜氧化,属于非还原性糖。淀粉在酸性溶液中加热可以水解,先水解为分子量较小的糊精,再水解成麦芽糖,最后水解为葡萄糖:

存在于动物肝脏和肌肉中的多糖,亦称肝糖,是动物淀粉,其结构与支链淀粉类似,但分支程度更高,是动物贮存营养物质的主要形式。
淀粉的用途
淀粉大量存在于植物的种子和块根、块茎中,是植物贮存营养物质的主要形式,也是动物体摄取的主要营养物质,因此淀粉可供食用以及食品工业的再加工。也用于制葡萄糖和酿洒(参看乙醇的工业制法)。纤维素是自然界最丰富的天然有机高分子化合物,也是由葡萄糖缩合而成的多糖,其平均分子量为2.5×105-1×106,是构成植物细胞壁的基础物质。它是长链线型分子,分子间相互作用成束状有序排列,称为纤维状,不溶于水和有机溶剂,但能溶胀。纤维素比淀粉难以水解,在酸性溶液中,水解的最终产物是葡萄糖。纤维素分子中的葡萄糖单元是相互扭曲着的,这样使若干纤维素分子的长链扭曲在一起形成绳索状结构,这些绳索再排列起来形成肉眼能见到的纤维,因此具有一定强度和化学稳定性,可以进行纺织成型。纤维素的分子中,每一个葡萄糖单元有3个羟基,能显示醇的性质,可以和硝酸、醋酸等发生酯化,得到纤维素无机酸酯。因此纤维素的用途广泛,除供纺织,造纸外,并可制人造丝、人造棉、玻璃纸、无烟火药、火棉胶、赛璐珞制品及电影胶片等。
纤维素醋酸酯
俗称醋酸纤维,由纤维素在硫酸催化下与乙酸酐酯化生成:

实际上纤维素分子中的羟基不可能全部酯化,不同酯化程度的醋酸纤维有不同的性能和用途。酯化程度接近100%的,用于制电影胶片和绝缘材料;酯化程度达80%的,用于制人造丝和香烟的过滤嘴;酯化程度70%左右的,用于制造塑料和清漆。酯化程度大的在有机溶剂中溶解性小。醋酸纤维对光稳定,不燃烧,耐酸不耐碱。
蛋白质的组成
由α-氨基酸通过肽键结合而成的天然有机高分子化合物。分子量为6×103-106,其元素组成除含碳、氢、氧外,均含氮和少量硫。蛋白质的结构很复杂,多肽链内的多种α-氨基酸以一定顺序排列,肽链上不直接相连的氨基之间通过特殊的分子间力(氢键)结合、盘旋、叠合呈空间结构,因此蛋白质是以多种氨基酸为单体的高聚酰胺。蛋白质种类繁多,水解产物均是α-氨基酸的称为单纯蛋白质。单纯蛋白质与非蛋白质的结合物叫结合蛋白,如脂蛋白、糖蛋白、血红蛋白等。单纯蛋白质又可分为不溶于水的纤维蛋白,如毛发、丝、爪甲等;可溶于水的球蛋白,如血清蛋白、酶等。研究蛋白质的组成、结构和合成,进一步探索生命现象,是科学研究的重要课题。1965年我国科学家在世界上第一次用人工方法合成了具有生命活力的蛋白质-结晶牛胰岛素。
蛋白质的性质
由于蛋白质分子大,溶于水的分散系有胶体特征,蛋白质颗粒带有电荷,使之相互排斥,其溶液比较稳定。若加入高浓度的氯化钠、硫酸钠、硫酸铵等盐类,可以中和蛋白质分子表面的电荷,使蛋白质沉淀,称为盐析。盐析作用一般是可逆的。沉淀时,蛋白质结构与生理活性不变,稀释后仍可溶解。
蛋白质分子受到某些物理因素(如加热、高压、超声波、紫外线、X射线等)和化学因素(如强酸、强碱、重金属盐、酒精等有机溶剂)的影响,其内部结构发生变化,从而失去生物活性,并发生物理、化学性质的变化,称为变性。如鸡蛋白溶液中加入硝酸铅、硫酸铜、硝酸汞等重金属盐,立即出现沉淀。高温、紫外线、酒精的消毒杀菌都是使蛋白质变性,这种变性是不可逆的,消除影响因素后,蛋白质的生理活性也不可恢复。
蛋白质分子中还有残留的、未形成肽键的氨基与羧基,因此也具有两性。有些蛋白质(分子中含苯环)和浓硝酸作用呈黄色,称颜色反应。
蛋白质的用途
“没有蛋白质就没有生命”,说明了生命现象与蛋白质的密切关系。它是人和动物不可缺少的营养物质。动物的毛和蚕丝的成分都是蛋白质,是重要的纺织原料。动物的皮经药剂鞣制后得到柔软坚韧的皮革。骨、皮等熬煮得到无色透明的动物胶,叫做白明胶,是制造照相感光片和感光纸的原料。牛奶中的蛋白质-酪素还能跟甲醛合成酪素塑料。
核 酸
一类生物高分子化合物,存在于一切生物体内,是组成细胞的重要成分。它以与蛋白质结合的形式--核蛋白存在于细胞中,是生命的基本物质之一,具有储存、复制生物体遗传信息的功能,也是蛋白质合成不可缺少的物质,因此它对于生物体的生长、遗传、变异等现象起着重要的决定作用。核酸分为两大类--核糖核酸(RNA)和脱氧核糖核酸(DNA),它们的分子量、分别为104-106和106-1016。在核酸分子中,主链由核糖(或脱氧核糖)与磷酸通过磷酸二酯键连接,主链上连接不同的碱性基,这些碱基的排列顺序就是遗传密码。核酸分子具有复杂的高级结构。我国在人工合成具有生物活性的核糖核酸和测定核酸结构方面的研究,都居世界领先地位。以脱氧核糖酸为例,其结构示意图如下页图。
酶
是一种具有生物活性的蛋白质,有单纯酶和结合酶两种。单纯酶只含蛋白质,不含其它物质,其催化活性仅由蛋白质的结构决定。结合酶则由单纯蛋白质和辅基组成,辅基是结合酶催化活性中不可缺少的部分。根据催化反应的类型,可以把酶分成六大类:(1)氧化还原酶--如细胞色素氧化酶、乳酸脱氢酶、氨基酸氧化酶。(2)水解酶--如胃蛋白酶、淀粉酶、蔗糖酶、脂肪酶等。(3)转移酶--如转氨酶等。(4)裂解酶--如碳酸酐酶等。(5)异构酶-如磷酸葡萄糖异构酶等。(6)合成酶--如谷氨酰胺合成酶、谷胱甘肽合成酶等。酶是一种生物催化剂,它具有一般催化剂的共性,但是酶的催化能力和催化反应条件有其自身的特异性:(1)酶的催化效力远远超过化学催化剂(高108-109倍)。(2)酶催化剂具有高效化学选择性,能从混合物中选择特定异构体进行催化反应。(3)酶催化剂对反应条件要求苛刻,如pH值、温度都各有特定的界限,超出界限即可引起酶蛋白的变性与分解。对酶催化剂特异性的研究与突破,将使有机合成飞速发展,这正是有待于我们探索的。

氨基酸
羧酸分子中烃基上的氢原子被氨基取代而成的有机化合物,即分子中含有氨基和羧基两种官能团。已知的氨基酸有数百种,但在生物体内,作为蛋白质合成原料的氨基酸主要有20种,它们均为α-氨基酸(氨基连在与羧基直接相连的α碳原子上),通式为

氨基酸分子中,同时含有碱性的氨基(-NH2)和酸性的羧基(-COOH),具有胺类与羧酸类的通性,是两性化合物,与强酸反应生成铵盐,

与氢氧化钠溶液反应生成羧酸钠盐,

一个氨基酸分子中的羧基和另一个氨基酸分子中的氨基之间,经缩合反应生成二肽,氨基酸是无色晶体,易溶于水,难溶于乙醚等非极性有机溶剂。氨基酸是构成蛋白质的基石,在人体蛋白质合成所需的20种氨基酸中,

有8种人体不能制造,必须由食物中获得,例如赖氨酸

在植物性食物中含量较少,因此常添加赖氨酸制造强化食品以满足病人和儿童需要。α-氨基酸除作为营养物质外,还是重要的化工原料。常用的调味品-味精就是谷氨酸钠盐
蔗 糖
自然界分布最广的非还原性二糖,分子式C12H22O11,存在于许多植物中,以甘蔗和甜莱中含量最高,因此得名。纯净的蔗糖是无色晶体易溶于水,比葡萄糖、麦芽糖甜,但不如果糖甜。蔗糖是由一分子葡萄糖和一分子果糖缩合失去一分子水而成,葡萄糖分子中的醛基和果糖分子中的酮基都被破环,因此没有还原性,属非还原性二糖。蔗糖在酸或蔗糖酶的作用下,水解生成等量的葡萄糖和果糖。因此其水解产物有还原性。

蔗糖遇浓硫酸发生脱水反应,生成复杂的混合物,其中有黑色的炭。蔗糖是各种食品的主要甜味剂,也可用于制葡萄糖和果糖。
麦芽糖
是一种还原性二糖,分子式C12H22O11,与蔗糖互为同分异构体,它由两个葡萄糖分子失去一分子水缩合而成,分子中保留一个醛基,因此具有还原性。麦芽糖在稀酸中水解得到两分子葡萄糖:

麦芽糖是淀粉的基本组成单位,可以说淀粉是麦芽糖的高聚物。用淀粉酶水解淀粉可以得到麦芽糖(参看淀粉的性质)。麦芽糖的甜度低于蔗糖,是饴糖的主要成分。
天然有机物
主要指油脂、糖类、蛋白质、天然橡胶这些自然界分布很广泛都是在生物体内合成的有机化合物,因此称为天然有机物。其中油脂、单糖、双糖、氨基酸等属于小分子的天然有机化合物。而多糖(淀粉、纤维素)、蛋白质则属于天然有机高分子化合物。油脂、糖类、蛋白质是人们食物中的三种重要成分,更是生物、生理与化学联系的重要纽带。它们在生物体内,由简单到复杂,再由复杂到简单(合成→分解→合成)的变化过程,
下表所列为合成人体蛋白的α-氨基酸

续表1

续表2

续表3

正是生物体的生长、发育等生命现象中的化学过程。学习有关它们的基础知识,对于了解生命现象的本质、从事工农业生产和科学研究都是重要的
高分子化合物
又称高聚物,是由几百-几千个原子、彼此以共价键连结起来的大分子化合物,具有较大的分子量(5×103-106)。此类化合物虽然分子量很大,但其化学组成、结构一般比较简单(蛋白质例外),通常是以简单的结构单元为链节,通过共价键重复结合而成高聚物。如聚氯乙烯的形成与结构就是这样的。

此处氯乙烯这种能聚合成高分子化合物的小分子化合物称为单体,组成高分

一种高聚物来说,n并不相同,所以高分子化合物的分子量是指平均分子量。
高分子化合物的分类众多,按其元素组成可分无机高分子化合物(如石棉、云母等)和有机高分子化合物(如橡胶、蛋白质);按其来源可分天然高分子化合物(淀粉、天然橡胶、蛋白质、石棉、云母)和合成高分子化合物(合成塑料、橡胶、纤维);合成高分子化合物又可按生成反应类型分加聚物(聚乙烯、聚氯乙烯……)和缩聚物(聚酰胺、聚酯、酚醛树脂);按链的结构可分线型高分子(合成纤维等)和体型高分子(酚醛树脂)等。高分子化合物分子中的各种官能团,都能正常发生反应,如羰基加成、脱碳,酯和酰胺水解等。由于分子量大,结构特殊,它们各自有其独特的物理性质。作为高分子材料,正是利用了这些性质(参看各具体条目)。
2.加成(氢化)含不饱和脂肪酸的油脂催化加氢后可以转化为饱和程度高的固态、半固态的脂肪,此反应称为油脂的氢化或硬化。例:

工业上常用此反应将多种植物油(如棉籽油)转变为硬化油,硬化油性质稳定,不易变质、便于运输,可用做制肥皂、脂肪酸、甘油、人造奶油等的原料。
1.水解油脂在酸(如H2SO4)存在条件下水解、生成高级脂肪酸和甘油(工业上制取它们的主要方法)。例:

油脂在碱(如NaOH)存在条件下水解,生成高级脂肪酸的钠盐和甘油,高级脂肪酸的钠盐就是肥皂。因此,油脂在碱性条件下的水解也叫“皂化”反应。
0.9625克/厘米3(100℃),不溶于水,易溶于苯、乙醚和热乙醇,易升华,有特殊气味。化学性质与苯相似,取代反应比加成反应容易进行。萘的取代

例如:

萘比苯容易氧化:

邻苯二甲酸酐是制染料、药物、塑料的重要原料。工业上的萘大部分用于生产邻苯二甲酸酐。煤焦油中含萘可达10%,可以从煤焦油的中油馏分或右油产品裂化所得的高沸点镏分用结晶法分离获得
乙醇的物理
性质乙醇分子由烃基(-C2H5)和官能团羟基(-OH)两部分构成,其物理性质(熔沸点、溶解性)与此有关。乙醇是无色、透明、有香味、易挥发的液体,熔点-117.3℃,沸点78.5℃,比相应的乙烷、乙烯、乙炔高得多,其主要原因是分子中存在极性官能团羟基(-OH)。密度0.7893克/厘米■,能与水及大多数有机溶剂以任意比混溶。乙醇水溶液的体积百分数称为“度”,用来表示乙醇的浓度。各种饮用酒里都含有乙醇,啤酒含3-5%(3-5度),葡萄酒含6-20%(6-20度),黄酒含8-15%(8-15度),白酒含50-70%(50-70度)。酒精过量能引起中毒,因此青少年不能饮用含酒精的饮料。工业酒精含乙醇约95%。含乙醇达99.5%以上的酒精称无水乙醇。含乙醇95.6%水4.4%的酒精是恒沸混合液,沸点为78.15℃,其中少量的水无法用蒸馏法除去。制取无水乙醇时,通常把工业酒精与新制生石灰混合,加热蒸馏才能得到。工业酒精和卫生酒精中含有少量甲醇,有毒,不能掺水饮用。
乙醇的化学性质
主要是由羟基(-OH)官能团引起的,在化学反应中涉及到两种键的断裂:C-O键断裂而脱掉-OH,如与氢卤酸的取代反应和浓硫酸存在下的脱水反应;或O-H键断裂而脱掉-H,如与金属钠的置换反应和有机酸的酯化反应;与羟基相连碳原子上的氢还能发生氧化反应。如下表页所示。
乙醇的用途
乙醇是应用最广泛的一种醇。因其性质比较活泼,是有机合成的重要原料,如用乙醇制乙醚、乙醛、乙酸等;因它具有广泛的溶解性,是重要的有机溶剂,用于溶解树脂、制作涂料等;因其在空气中燃烧充分,可避免污染,而且燃烧热值较大。


可用作内燃机和实验室的燃料;因75%的酒精能立即使蛋白质变性(凝固),在医药上常用作消毒剂和防腐剂;乙醇还广泛用作饮料和食品添加剂,但必须注意:不能超量饮用,以免引起酒精中毒,青少年尤其不宜饮用含酒精的饮料;工业酒精中含有毒性的甲醇,决不能饮用。
乙醇的工业制法
我国劳动人民早在几千年前就掌握了发酵酿酒术,至今,发酵法仍是制备乙醇的重要方法。发酵法以富含淀粉的各种谷物和野生果实为原料,经下列过程成为发酵液:

发酵液内含乙醇10-15%,发酵液经蒸馏可得含95.6%的乙醇和4.4%水的恒沸液液,称为工业酒精。目前工业上大量生产的乙醇,是以石油裂解气中的乙烯为原料利用水化法制得的(催化剂为硫酸或磷酸):

乙二醇

-11.5℃,沸点198.0℃,密度1.1088克/厘米3,能与水、乙醇混溶(不溶于乙醚)。60%乙二醇水溶液的凝固点是-49℃,因此乙二醇可作内燃机抗冻剂。乙二醇具有一元醇的某些化学性质,如能生成醚、酯等物质。乙二醇可与对苯二甲酸发生酯化反应(缩聚)而合成俗称涤纶的聚酯纤维:

工业上以乙烯为原料,先氧化或环氧乙烷,然后水解即得乙二醇:

丙三醇

味的液体,熔点20℃,沸点290℃(分解),密度1.2613克/厘米3,有强烈的吸湿性,与水、酒精以任意比互溶,因此常用做化妆品、皮革、烟草、食品、纺织品的吸湿剂和滋润剂。它与硝酸酯化生成三硝酸甘油酯(又称硝酸甘油、硝化甘油):

它是一种烈性炸药的主要成分。硝化甘油有扩张冠状动脉的作用,用做心绞痛急救药。在自然界中,甘油以酯的形式存在,各种动植物油脂都是甘油的高级脂肪酸酯。水解油脂便可得到脂肪酸和甘油(参看油脂的性质)。
乙 醚
分式C4H10O,结构简式CH3CH2-O-CH2CH3是无色易挥发有特殊气味的液体,熔点-116.2℃,沸点34.5℃,密度0.7138克/厘米3。乙醚易燃,其蒸气与空气混合到一定比例时会发生爆炸,遇热金属也会着火,故贮存、使用时应避开火源,注意安全。乙醚微溶于水,能溶解多种有机物是良好的有机溶剂。纯净的乙醚在医疗上用做手术时的全身麻醉剂。工业上乙醚可由乙醇分子间脱水制得:

随着石油工业发展,乙醚亦可由石油化工产物乙烯制取,其方法是用硫酸吸收乙烯,形成硫酸乙酯,再水解得到乙醇和乙醚。通过改变温度和试剂浓度,可控制生成醇和醚的比例。
苯酚的物理性质
纯净苯酚为无色或白色晶体(常见的苯酚呈粉红色,是被空气氧化所致),熔点43℃,沸点181.75℃,密度1.0576克/厘米3,室温时微溶于水,70℃以上时,能与水以任意比互溶。苯酚易溶于乙醇、乙醚等有机溶剂。苯酚有毒,它的浓溶液对皮肤有强腐蚀性,沾到皮肤上应立即用酒精洗涤
苯酚的化学性质
苯酚分子中含有羟基(-OH),也可以发生O-H键断裂和C-O键断裂。但酚与醇结构不同,酚羟基与苯环直接相连,因此酚的O-H键容易断裂,而C-O键却很难断裂,此外由于酚羟基的影响,增大了苯环上邻、对位上氢的活性,容易被取代。(见下页表)
苯酚的用途
苯酚是一种重要的有机合成原料,可用来制取酚醛塑料(电木)、*合成纤维(锦纶)、医药、染料、农药等。苯酚可凝固蛋白质,有杀菌效力,苯酚稀溶液是医药上最早使用的喷洒消毒剂,商品“来苏儿”(Lysol)消毒药水就是苯酚和甲苯酚的肥皂液,药皂中也掺入少量的苯酚。苯酚催化加氢即生成环己醇,是合成尼龙66的原料之一:


苯酚的工业制法
苯酚有四种工业制法。(1)苯酚和它的同系物存在于煤焦油中,可将煤焦油的中间馏分,经碱液提取,再经酸化制取苯酚,但此法产量有限。

(2)苯磺酸碱熔法

此法产率高,但操作工序繁多,消耗大量硫酸和烧碱,对设备腐蚀严重。
(3)氯苯水解法

(4)异丙苯氧化水解法

此法每生产一吨苯酚可同时获得0.6吨丙酮。
乙醛的物理性质
常温下为无色有刺激性气味的液体,密度比水小(0.7834克/厘米3,18℃)熔点为-121℃*,沸点为20.8℃,易挥发。易溶于水、乙醇、乙醚和氯仿中
乙醛的化学性质


荷的试剂加到带部分正电荷的碳上,带正电荷的试剂加到带部分负电荷的氧上;乙醛分子中与羰基相连的氢和α碳上的氢都有一定活泼性,可发生氧化还原反应及α-氢的取代反应。
乙醛的用途
乙醛是有机合成工业中的重要原料,可用于合成乙酸、乙酐、乙醇、丁醇、三氯乙醛、氯仿等。例如,工业上,乙醛在一定温度和催化剂[Mn(Ac)2]条件下,被空气氧化成乙酸:
2CH3CHO+O2 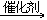 2CH3COOH
2CH3COOH
又如氯仿反应:
* 乙醛分子中有C=O极性的影响,沸点比相应的乙烷(C2H6)、甲醚(CH3-O-CH3)高,但乙醛分子间不能形成氢键,其沸点比乙醇低。



乙醛的工业制法
乙醛有三种工业制法。(1)最早是用乙醇氧化法制乙醛

此法要消耗大量粮食,已不再采用。(2)工艺比较成熟的是乙炔水化法,产率和产品纯度高。

但汞盐毒性很大,严重污染环境。(3)乙烯直接氧化法,这是乙醛的最新制法。

该法产率高而无污染,是1956年原联邦德国的Wacker公司开发的,故又称瓦格(Wacker)法。
甲 醛

熔点-92℃,沸点-21℃,液态时的密度为0.815克/3厘米(20℃),易溶于水和乙醇,35-40%的甲醛水溶液叫做福尔马林。甲醛分子中有醛基

生缩聚反应,得到酚醛树脂(电木):

甲醛是一种重要的有机原料,主要用于塑料工业(如制酚醛树脂、脲醛塑料-电玉)、合成纤维(如合成维尼纶-聚乙烯醇缩甲醛)、皮革工业、医药、染料等。福尔马材具有杀菌和防腐能力,可浸制生物标本,其稀溶液(0.1-0.5%)农业上可用来浸种,给种子消毒。工业上常用催化氧化法由甲醇制取甲醛:

酚醛树脂
是酚与醛经缩聚反应而合成的树脂(塑料的统称,其中以苯酚和甲醛树脂为最重要。也是世界上最早由人工合成的,至今仍很重要的高分子材料。酚醛树脂为热固性树脂,与其它热固性树脂相比,其优点有:(1)固化时不需要加入催化剂、促进剂,只需加热、加压,调整酚与醛的摩尔比与介质pH值,就可得到具有不同性能的产物。(2)固化后密度小,机械强度、热强度高,变形倾向小,耐化学腐蚀及耐湿性高,是高绝缘材料。其缺点是脆性大,颜色深,加工成型压力高。它与其它配料制成的产品叫酚醛塑料,高绝缘,俗称电木,广泛应用于电气工业、化学工业,还可用做涂料、粘合剂、清漆。教材所列酚醛树脂缩合过程为线型酚醛树脂(参看苯酚的化学性质),体型酚醛树脂结构示意图为:

丙 酮

-95.35℃,沸点56.2℃,密度0.7899克/厘米3,可与水、乙醇、乙醚等以任意比互溶,还能溶解脂肪、树脂和橡胶等多种有机物,是一种重要的有机溶剂。丙酮易燃,其蒸气与空气混合气的爆炸极限为2.55-12.80%。丙酮

被氧化。丙酮是重要有机合成原料,可以制取醋酸酐、氯仿、碘仿、环氧树脂、有机玻璃(α-甲基丙烯酸甲酯是合成有机玻璃的单体)等。丙酮的用量大,制备方法也多,异丙苯氧化制苯酚的副产物就是丙酮(参看

苯酚的工业制法),工业上的一种新方法是用石油裂解气中的丙烯催化氧化,此法产率高、副反应少。

乙酸的物理性质
是一种无色有强烈刺激性气味的液体,熔点是16.6℃,沸点是117.9℃,密度1.0492克/厘米3,当室温低于16.6℃时,无水乙酸就凝结成冰一样的晶体,故通称冰醋酸。它是食醋的主要成分,普通食醋中含有3-5%乙酸,所以乙酸俗称醋酸。与水互溶并易溶于有机溶剂。
乙酸的化学性质

合而成,又彼此影响,因此表现酸性,还可以发生羟基取代生成羧酸衍生物及与羧基直接相连甲基上的氢原子(α-H)的取代反应等。(见表)

乙酸的用途
是人类使用最早的酸,在古代就用发酵法酿醋作食品调料。它是重要的有机化工原料,可以生产醋酸纤维(参看纤维素醋酸酯)、合成纤维(如维纶)、醋酸酐、醋酸酯(广泛用做溶剂),也是染料、香料、医药、塑料、油漆工业不可缺少的原料。
乙酸的工业制法
最早使用的方法是用粮食发酵法酿醋,至今食醋仍用此法生产,先由淀粉发酵制得酒精,再进一步在醋酸菌作用下氧化为醋。

现在工业上大量用合成法制备,即由乙烯或电石合成乙醛(参看乙醛的工业制法),乙醛在乙酸锰的催化下被氧化成乙酸:

1966年孟山都(Monsanto)公司开发的甲醇羰基化合成乙酸,是乙酸工业制法的重大突破。

此法反应速度快而产率高,而甲醇又可以由一氧化碳和氢制得。

这就意味着可由一氧化碳和氢合成乙酸。目前国外每年用此法生产的乙酸已达千万吨,是最有前途的一种制法。
乙酸的沸点高是因为乙酸分子间能以氢键相互结合成双分子缔合的二聚体。

油脂的成分
油脂是高级脂肪酸甘油酯的总称。常以下式表示:

结构式中的R1、R2、R3绝大多数是含十个碳原子以上的单数碳原子的直链烃基,其中有饱和的,也有不饱和的(天然油脂中的脂肪酸多数为C12-C18的双数碳原子的直链脂肪酸)。如果R1、R2、R3相同,称为单(纯)甘油酯;如果R1、R2、R3不相同,称为混(合)甘油酯。天然油脂大都为混甘油酯
高级脂肪酸
通常以酯的形式广泛存在于油脂和蜡中。天然来源的高级脂肪酸大多数是含双数碳原子的直链羧酸,其中有饱和的,也有不饱和的,其熔点通常是饱和高级脂肪羧酸高于同碳原子数的不饱和羧酸。下页表为几种重要的高级脂肪酸:

油脂的性质
油脂比水轻,密度在0.9-0.95克/厘米3。不溶于水,易溶于汽油、乙醚、氯仿、丙酮、苯及热乙醇等有机溶剂中(工业上用有机溶剂提取植物种子里的油)。天然油脂都是混合物,所以没有恒定的熔点和沸点,构成油脂的脂肪酸的饱和程度,对油脂的熔沸点有一定影响。液态油比固态脂肪含有较多的不饱和脂肪酸甘油酯。油脂的化学性质与其结构有关,重要性质有水解、加成、氧化等。
5.氧化 常用的氧化剂K2Cr2O7或CuO

连接-OH的碳原子上如果没有氢原子,则很难氧化。如在隔绝空气条件和以Cu、Ag为催化剂时,则发生脱氢反应

苯酚的结构

似的。苯酚分子中羟基(-O-H)中的氢原子不与苯环处于同一平面上,而是位于苯环所处平面的一侧。羟基的氧原子含有孤对电子,这孤对电子的电子云受苯环电子云的作用而向苯环转移,因之诱导氢氧原子间的电子云向氧原子方向转移,使羟基中氢原子的离子化倾向大为增强,使苯酚在水中能微弱电离而呈弱酸性。

苯酚分子中,由于羟基的存在,使得苯环的活泼性增强,特别是羟基的邻对位上的氢原子易被取代。
酚 类
芳香烃苯环(苯环或稠苯环)上的一个或几个氢原子被羟基(-OH)代换后的生成物属酚类。如:

都属酚类。根据分子中含羟基的数目,酚类可分为一元酚、二元酚、多元酚。绝大多数酚为结晶固体,多数微溶或难溶于冷水,较易溶于热水,溶于乙醇、乙醚等有机溶剂,如沾有酚类的玻璃容器需用乙醇清洗。酚类是芳香烃基和羟基结合而成,但芳香烃基和羟基之间存在着相互影响,使羟基具有不同于醇羟基的新的特性,即酸羟基显示弱酸性,能跟强碱作用生成酚盐;同时,芳香烃基受羟基的影响,较芳香烃易发生卤化、硝化、磺化等取代反应,如苯不跟溴水发生反应,而苯酚却跟溴水很容易反应生成三溴苯酚。大多数酚跟FeCl3溶液作用显示特殊颜色,如苯酚遇FeCl3。溶液显示紫色。酚来源于煤焦油或芳香烃经磺化再经碱熔而得。酚的主要用途是制染料、药物、酚醛类树脂等。
乙醛的结构


同,两个碳氧键的键能并不相同,其中一个较小,容易断裂。由于羰基里的氧原子的吸引电子能力强,碳氧双键的电子云向氧原子转移;因之诱导碳氢键的电子云向碳原子有一定程度的转移,故醛基里碳氢键不完全同于烃分子里的碳氢键而具有较特殊的性质,如较易结合氧转化成羟基。
醛 类

醛基简写为-CHO,不要写成-COH。根据醛基所结合的烃基的结构,醛可分为脂肪族醛和芳香醛。脂肪族醛又可再分为饱和脂肪醛和不饱和脂肪醛。饱和脂肪醛如乙醛(CH3-CHO)、丙醛(CH3-CH2-CHO)等,其中甲醛、乙醛、丙醛溶于水,C4以上的醛由微溶于水至难溶于水;不饱和脂肪醛如丙烯醛(CH2=CH-CHO),油脂过热时往往出现有辛辣气味气体产生,


的化学性质相似,能加氢还原成醇、易发生氧化反应(银镜反应、碱性Cu(OH)2生成红色Cu2O)而成羧酸。许多醛具有工业价值,如甲醛制酚醛塑料,40%甲醛水溶液(福尔马林)在医药上作防腐剂,甲醛又是合成维纶的原料之一,乙醛用于合成醋酸等。
缩聚反应
具有两个或两个以上官能团的单体,相互反应生成高分子化合物,同时产生有简单分子(如H2O、HX、醇等)的化学反应。如:甲醛跟过量苯酚在酸性条件下生成酚醛树脂(线型)

在碱性和甲醛过量条件下,则生成网状高分子

再如:由对苯二甲酸和乙二醇含成聚酯树脂

缩聚反应是合成高分子化合物的基本反应之一,在有机高分子化工领域有重要应用。
乙酸的结构


电子云偏向氧原子。羟基里的氧原子含有孤对电子,这孤对电子的电子云能和碳氧键的电子云有所重叠,使得羟基里氧原子的电子云向羰基转移,同时诱导氢氧键的电子云向氧原子转移,即氢氧键的极性增强了,在水溶液中能电离出H+而显示酸性。电子云的转移如示:

羧 酸
除甲酸外,羧酸是烃基和羧基结合成的化合物。按烃基不同,羧酸可分为脂肪酸和芳香酸,脂肪酸又可分为饱和脂肪酸和不饱和脂肪酸。饱和脂肪

苯甲酸C6H5COOH。按分子中的羧基数目又可分为一元酸、二元酸等,如乙酸和己二酸HOOC-(CH2)4COOH等。低级脂肪酸在常温是液体,可溶于水,有刺鼻气味,中级脂肪酸是液体,微溶于水或难溶于水。饱和高级脂肪酸为固体,而不饱和高级脂肪酸多为液体,饱和高级一元脂肪酸如十八酸CH3(CH2)16COOH为白色蜡状固体,而十八烯酸C17H33COOH则为油状液体;不饱和程度更大的脂肪酸如十八碳三烯酸,也是液体。芳香酸是结晶固体,在水中溶解度不大。羧酸的沸点比分子量相当的烷烃、卤代烃、醇等都要高,这是因为在羧酸的分子间能以氢键作用产生分子缔合的结果,缔合作用示意如下:

羧酸具有酸的通性,即跟活泼金属反应,置换羧基中羟基的氢、跟碱中和成羧酸盐和水、跟Na2CO3反应生二氧化碳、溶于水使石蕊变红(不溶于水的不

剂(氢化铝锂LiAlH4)作用下可还原成醇。芳香羧酸的苯环上可以发生取代(如卤化、硝化等)反应。羧酸广泛用于合成树脂、染料、医药和香料工业中。
酯
酯是酸(羧酸或无机含氧酸)跟醇脱水生成的化合物。酯的一般通式为


硝酸乙酯,(C2H5O)2SO2硫酸乙酯。此外,还有碳酸酯和磷酸酯等。根据羧酸酯的结构简式命名时,首先要正确区分哪部分基团来自羧酸,哪部分来自醇。酰基来自羧酸,其余部分来自醇。如:

虚线左侧部分是乙酰基(两个),右侧部分来自醇(乙二

是丙酰基,左侧部分来自醇(甲醇),该化合物名称为:丙酸甲酯。酯类广泛存在于自然界中。低级羧酸酯是有芳香气味的液体,存在于各种水果和花草中,如梨里含乙酸异戊酯。虫蜡中含高级脂肪酸与高级一元醇组成的酯,动植物脂肪主要是高级脂肪酸与甘油组成的酯。酯类一般难溶于水,比水轻,易溶于乙醇、四氯化碳、乙醚等有机溶剂。人工合成的低级羧酸酯常用做食品香料或有机溶剂。高级脂肪酸甘油酯,有的供食用,有的还是制造高级脂肪酸、甘油、肥皂、油漆的原料。酯类的重要化学性质是能发生水解。在酸性条件下,水解生成酸和醇;在碱性条件下,水解生成盐和醇。
酯化反应
醇跟酸生成酯和水的反应,叫酯化反应。分两种情况:羧酸跟醇反应和无机含氧酸跟醇反应。羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯。这是曾用示踪原子证实过的。如

羧酸跟醇的酯化反应是可逆的,并且一般反应极缓慢,故常用浓硫酸作催化剂。多元羧酸跟醇反应,则可生成多种酯。如乙二酸跟甲醇可生乙二酸氢甲酯或乙二酸二甲酯。
HOOC-COOH+CH3OH  HOOC-COOCH3+H2O
HOOC-COOCH3+H2O

无机强酸跟醇的反应,其速度一般较快,如浓硫酸跟乙醇在常温下即能反应生成硫酸氢乙酯。
C2H5OH+HOSO2OH→C2H5OSO2OH+H2O
硫酸氢乙酯
C2H5OH+C2H5OSO2OH→(C2H5O)2SO2+H2O
硫酸二乙酯
多元醇跟无机含氧强酸反应,也生成酯,如:

水解反应
水解反应通常包括盐水解和有机化合物水解两类。这里是指有机化合物的水解。有机化合物的水解是有机物分子中的某种原子或原子团被水分子的氢原子或氢氧原子团代换的反应。有机化合物的水解速度通常很缓慢,常常需用催化剂(酸或碱)。如卤代烃、酯(含油酯)、二糖、多糖等,都能发生水解。

酯的水解,如在碱性条件下,则生成羧酸盐和醇。有机化合物通过水解反应,在工业上有重要价值,如淀粉在酸性条件下水解后,经浓缩结晶,制得葡萄糖;油脂在碱性条件下水解后,经分离可制得肥皂和甘油。
水解反应
水解反应通常包括盐水解和有机化合物水解两类。这里是指有机化合物的水解。有机化合物的水解是有机物分子中的某种原子或原子团被水分子的氢原子或氢氧原子团代换的反应。有机化合物的水解速度通常很缓慢,常常需用催化剂(酸或碱)。如卤代烃、酯(含油酯)、二糖、多糖等,都能发生水解。

酯的水解,如在碱性条件下,则生成羧酸盐和醇。有机化合物通过水解反应,在工业上有重要价值,如淀粉在酸性条件下水解后,经浓缩结晶,制得葡萄糖;油脂在碱性条件下水解后,经分离可制得肥皂和甘油。
甲烷的物理性质
甲烷是烃类分子组成最简单的物质,化学式CH4。甲烷是无色、无味的气体,难溶于水,密度(标准状况)0.717克/升,沸点-161.5℃,熔点-182.48℃。沼气、坑气、天然气的主要成分是甲烷。天然气中的甲烷经低温和加压液化,可以用特殊船舶越洋运输。甲烷的化学性质甲烷性质稳定,跟酸性KMnO4溶液或溴水均不发生反应。在一定条件下,甲烷能发生卤代反应(Cl2,Br2)和热分解(分解成C、H2、C2H2等)等反应。甲烷燃烧时火焰呈青白色。点燃甲烷和空气的混合气会发生爆炸。甲烷在空气里的爆炸极限是5.3-14.0%(体积),在氧气里的爆炸极限是5.4-59.2%(体积)。
乙烯的物理性质
乙烯在常温常压下为无色气体,稍有香甜气味,比空气稍轻,难溶于水。沸点(常压)-103.71℃,熔点-169.15℃。
乙烯的化学性质
乙烯可燃,燃烧时火焰明亮。与空气形成爆炸性混合物。爆炸极限:下限3-3.5%,上限16-29%。由于乙烯分子中存在双键,性质活泼,容易进行加成反应。氧化反应和加聚反应。如:

乙烯的用途
乙烯是石油化工的一种基础原料,用于制造合成橡胶、合成树脂(如聚苯乙烯、聚氯乙烯)、合成纤维、炸药、乙醇、乙醛、醋酸、环氧乙烷等有机合成产品,并可以代替乙炔用以切割或焊接金属,还可以作为人工使水果成熟的促进剂。乙烯用于制造树脂和塑料的消费量最多。
橡 胶
有天然橡胶和合成橡胶。天然橡胶是从橡胶树流出的乳液制成的。巴西橡胶树是世界上种植面积最广和产量最高的品种。巴西橡胶树从19世纪后期才逐渐移植到东南亚地区,后来我国在海南岛、云南等地也大量种植,除此之外。有希望种植的还有银胶菊和橡胶草。割开橡胶树皮流出的白色乳液含橡胶20-40%,经酸化凝固、压片、熏烟制得干胶片,这就是生橡胶。生橡胶虽有弹性,其使用性能受温度和其它因素影响较大。生橡胶经硫化(1839年发明)后,其使用性能得到大大改善,这就是硫化橡胶,为橡胶工业的发展奠定了基础。橡胶树的栽培虽得到很大发展,但产量仍不能满足军事及工农业的需要。1900年-1910年化学家C.D.哈里斯(Harris)测定了天然橡胶的结构是异戊二烯的高聚物,其结构简式为:

这就为人工合成橡胶开辟了途径。1910年俄国化学家S·V列别捷夫(Lebedev,1874-1934)以金属钠为引发剂使1,3-丁二烯聚合成丁钠橡胶,以后又陆续出现了许多新的合成橡胶品种,如顺丁橡胶、氯丁橡胶、丁苯橡胶等等。合成橡胶的产量已大大超过天然橡胶,其中产量最大的是丁苯橡胶。
橡胶的硫化
生橡胶受热变软,遇冷变硬、发脆,不易成型,容易磨损;易溶于汽油等有机溶剂;分子内具有双键,易起加成反应,容易老化。生产上要进行硫化等一系列加工过程,以改善橡胶制品的性能。生橡胶的分子是线型高分子,呈蜷曲的形状,在外力作用下由蜷曲变为伸展,外力消失后又能够恢复其原蜷曲状态,这是具有弹性的必要条件。但链跟链之间容易滑动,强度和韧性差,必须经过交联,使分子链跟分子链之间有化学键的联系,通过交联,使线型高分子交联成网状结构,分子链间才不能滑动,具有可逆高弹变形,强度和韧性大为增强。变成有实用价值的橡胶。交联的方法通常是硫化。硫化就是在生橡胶中混炼入一定量的硫黄,然后把它放进成型模具内并加热(约140℃),硫原子即通过化学键使高分子链间发生交联,得到硫化橡胶制品。硫化过程是很复杂的,常是形成双硫键起交联作用。如图所示:(见下页)
硫化时,所加硫通常占总量3%左右,交联程度低,得到的橡胶制品有很好的弹性、韧性等;如果加硫达30%左右,高分子链的不饱和碳原子几乎都被交联,生成高度交联的体型分子,就是硬橡胶。

橡胶的老化
一般橡胶制品只达到轻度交联。高分子链上还有双键,受氧气、臭氧、日光,特别是高能辐射的作用,还容易老化。贮存或使用日久的车胎发生龟裂。乳胶手套或乳胶管会发粘或变硬变脆,其它橡胶制品会出现弹性下降,变硬开裂或变软发粘等,都是老化现象。橡胶的老化主要是化学老化,即由于发生复杂的化学反应而老化。化学老化可以分为降解和交联两种类型。降解是指高分子受紫外线、热、机械力等因素的作用而发生高分子链的断裂;交联是指高分子碳-氢键断裂,在高分子链间出现了新的结合而形成网状结构。降解和交联对橡胶的性能有很大影响。降解使高分子的分子量下降,材料变软、变粘,抗拉强度降低;交联使材料变硬、伸长率下降。空气中的氧气和日光照射是引起橡胶老化的主要因素。
乙炔的物理性质
CH≡CH。在常温常压下,纯净的乙炔是无色、略带酯味的气体,密度1.16克/升。熔点一81.8℃,升华点-83.6℃。微溶于水,溶于乙醇,易溶于丙酮。由电石跟水反应产生的乙炔,因含有H2S和PH3等杂质而具有难闻的气味。乙炔在不超过1.5公斤/厘米2压力下,可容入钢瓶里的丙酮中贮存。
乙炔的化学性质
乙炔和其它类烃相比,稳定性较差,易分解成碳和氢。乙炔分子分解时放出大量热,其热量足以使乙炔发生连锁反应,故乙炔在加压、加热时可能发生爆炸。某些金属及其氧化物对乙炔的分解有明显催化作用,而且氧化物远比纯金属剧烈。乙炔与金属铜接触产生高爆炸性的乙炔钢。在过热或撞击下,少量乙炔铜爆炸会迅速引起大量乙炔发生爆炸,故在生产乙炔和乙炔加工装置中,通常不允许使用铜和铜合金材料制造管道、阀门等。乙炔燃烧时,火焰明亮有浓厚黑烟。乙炔与空气能形成爆炸混合物,其爆炸范围较其它可燃气体都大。乙炔与氯气混合,在光照下即发生爆炸。乙炔的性质活泼,容易跟许多物质发生化学反应,如受酸性KMnO4溶液氧化,容易发生加成反应(Br2、H2、HCl等)和加聚反应等。
乙炔的用途
乙炔的化学性质很活泼,可跟许多物出发生化学反应,衍生出上千种有机化学品。如与氯化氢发生加成反应生成氯乙烯,氯乙烯作为单体经加聚反应得到聚氯乙烯;乙炔跟乙酸反应得到乙酸乙烯酯,可进一步制得维尼纶;乙炔二聚得乙烯基乙炔,进而跟氯化氢加成得氯丁二烯,氯丁二烯经加聚反应制得氯丁橡胶;乙炔跟氰化氢加成得丙烯腈,丙烯腈经加聚反应制得聚丙烯腈等。乙炔在纯氧气中燃烧所产生的温度很高,用于气焊和气割。
苯的物理性质
苯在常温下为无色透明液体。密度(15℃)0.885克/厘米3,沸点80.10℃,熔点5.53℃,易挥发,有强烈芳香气味。有毒。难溶于水,易溶于乙醇、乙醚等有机溶剂。
苯的化学性质
苯的化学性质较稳定,对酸性KMnO4溶液和溴水均无反应。易燃,燃时有浓黑烟。苯的化学反应可分为三大类:取代反应,如硝化反应和磺化反应;加成反应,如在镍为催化剂作用下,苯跟H2反应生成环己烷;苯环破裂反应,如苯在V2O5催化剂作用和加热条件下,用空气氧化生成顺丁烯二酸酐:

通过这些反应,可由苯制成多种重要的化学中间体,它们是合成橡胶、塑料、纤维、洗涤剂、染料、医药、农药、炸药等的重要基础原料。
苯的用途
过去,苯的主要用途是作汽油的掺合物,以提高汽油的辛烷值。随着石油化学工业的发展,作为化工原料的苯的用量越来越大,其中制苯乙烯、环己烷和异丙苯所耗用的量最多,约占世界总产量的80%。我国70年代纯苯的产量为16.67万吨,1983年达42.5万吨。苯的主要用途见下表:

甲 苯

有类似苯的芳香气味,沸点(常压)110.63℃,熔点-94.99℃。甲苯不溶于水,溶于乙醇、乙醚和丙酮。蒸气和空气形成爆炸性混合物,爆炸极限1.2-7.0%(体积)。如甲苯溶解溴后,在光照条件下,甲基上的氢原子被溴原子取代(与甲烷相似)而在铁作催化剂条件下,苯基上的氢原子被溴原子取代(与苯相似);但甲苯分子中存在着甲基和苯基的相互影响,使得甲苯又具有不同于苯和甲烷的性质,如苯环上的取代反应(卤化、硝化等),甲苯比苯容易进行,甲烷不受酸性KMnO4溶液氧化,而甲苯分子中的甲基则可以。

甲苯跟混酸(浓硝酸与浓硫酸的混合物)反应而得

三硝基甲苯(又称梯恩梯)是最重要的一种军事炸药。甲苯还用于制糖精、药物和染料等,并用作溶剂。由分馏煤焦油的轻油部分或由催化重整轻汽油馏分而制得。
二甲苯
化学式C6H4(CH3)2。无色透明易挥发的液体。有芳香气味,有毒,难溶于水,易溶于有机溶剂。由于甲基在苯环上的位置不同,二甲苯有三种同分异构体:

二甲苯的化学性质与苯有相似之处,如苯环上发生取代反应(卤化、硝化、磺化等);也有不同的一面,如受酸性KMnO4溶液氧化,甲基转化成羧基

对二甲苯用于生产对苯二甲酸,是聚酯纤维和工程塑料(PBT)的原料。邻二甲苯是生产苯酐的主要原料。二甲苯除从煤焦油获得少量外,大部分是由催化重整的轻汽油经分馏而得
石 油
从地下开采出来的一种粘稠的液体燃料。它是由古代低级动植物遗体在地壳和细菌作用下,经过长期复杂的生物、化学变化而形成的。从田里开采出来的未经加工处理的石油叫原油,通常显黑色或深棕色,有蓝(或绿)色荧光,有特殊的气味,不溶于水,密度比水小,没有固定的熔、沸点。其化学成分十分复杂,含有烷烃、芳香烃和环烷烃。主要的元素组成是碳、氢、氧、氮、硫,还含有水、氯化钙、氯化镁等无机盐。因此原油必须经脱水、脱盐处理后才能炼制。石油是一种极其重要的资源,经过分馏、催化裂化可以制得汽油、煤油、柴油等燃料和各种润滑油及许多气态烃(炼厂气)。以石油为原料,经过裂解等一系列化工过程可以制得三大合成材料(塑料、橡胶、纤维)等重要产品,因此,石油被称为“工业的血液”。我国石油储量丰富,除已开发的克拉玛依、大庆、大港、任丘、胜利等油田,我国大陆沿海、近海都蕴藏着丰富的石油资源,许多新油田正在勘探和建设中。我国的石油产量由1949年的12万吨、世界第27位上升到1984年的1.15亿吨、居世界第6位。现在我国原油加工能力已超过1.03亿吨。居世界第7位。
石油的分馏
在分馏塔中同时进行多次部分蒸发与部分冷凝,按不同的沸点范围,把精制过的原油分成不同馏分的石油加工过程。其主要设备是常、减压分馏塔。原油经过脱水和脱盐处理后,先进入常压分馏塔,操作时把从塔顶冷凝得到的液体的一部分重新打入塔内,与从塔底连续上升的蒸气充分接触,进行传热与传质,使液态中的低沸点物气化,蒸气中的高沸点物冷凝,从而提高原油中各组分的分离程度。由常压塔顶导出的液体馏分为直馏汽油、煤油柴油和重油,其中的直馏汽油主要成分以正构烷烃(C5-C11)为多,辛烷值低,不能直接用作动力燃料,需经催化重整;塔底导出的沸点400℃以上的重油加热后进入减压分馏塔,在减压状态下继续分馏,以提高各种直馏油分的产量。石油的常减压分馏又称石油的一级加工。所得馏分需经催化重整、催化裂化等二级加工才能成为各种优质油分。石油的分馏是物理过程。
石油的裂解
将石油分馏产品在比裂化更高的温度(800-1000℃)下进行深度裂化,主要得到小分子气态烃和少量轻质液态烃(汽油)。“裂解”和“裂化”虽是同一类反应,但目的不同,产物不同。裂解的主要目的是获得小分子气态烯烃、炔烃、烷烃的混合物,其中低级不饱和烃可直接成为合成塑料、橡胶、纤维的原料;而“裂化”(或“催化裂化”)则是为了提高汽油的产量和质量,以增加轻质燃料油为主要目的。石油的裂解是石油化工的主要组成部分,石油裂解气的主要成分--乙烯的产量通常作为衡量石油化工发展水平的标志。我国的石油化工起始于50年代,70年代后发展较快,乙烯及三大合成材料有了较大增长(见下表)

石油的裂解
将石油分馏产品在比裂化更高的温度(800-1000℃)下进行深度裂化,主要得到小分子气态烃和少量轻质液态烃(汽油)。“裂解”和“裂化”虽是同一类反应,但目的不同,产物不同。裂解的主要目的是获得小分子气态烯烃、炔烃、烷烃的混合物,其中低级不饱和烃可直接成为合成塑料、橡胶、纤维的原料;而“裂化”(或“催化裂化”)则是为了提高汽油的产量和质量,以增加轻质燃料油为主要目的。石油的裂解是石油化工的主要组成部分,石油裂解气的主要成分--乙烯的产量通常作为衡量石油化工发展水平的标志。我国的石油化工起始于50年代,70年代后发展较快,乙烯及三大合成材料有了较大增长(见下表)

石油化工
是指以石油天然气为原料,生产基本有机化工原料,并进一步合成多种化工产品的工业。其原料来源主要有天然气、炼厂气、液体石油产品或原油。原料烃类分子中含氢量越高,分子量越低,乙烯产率越高。裂解反应是强烈的吸热反应,因此原料在管式炉(或蓄热炉)中经过700-800℃甚至1000℃以上的高温加热,所得裂解产物通常称为石油化工一级产品,通常称为三烯、三苯、一炔、一萘(乙烯、丙烯、丁二烯、苯、甲苯、二甲苯、乙炔和萘)。石油化工的一级产品再经过一系列加工则可得二级产品,如乙醇、丙酮、苯酚等二三十种重要有机原料。因此石油化工已成为现代有机合成的基础工业。我国石油资源丰富。石油化工的发展迅速,1949年我国原油加工能力约17万吨,只有蒸馏、热裂化、叠合、离心脱蜡等少数炼油装置,而且规模都很小,50年代恢复并建成年加工原油100万吨的兰州炼油厂,60年代依靠自己的力量建成年加工原油150万吨的大庆炼油厂,而且掌握了延迟焦化、催化裂化、铂重整、尿素脱蜡、分子筛脱蜡……等新型工艺及装置,大大缩短了与世界炼油技术先进水平的差距。到1984年,我国已拥有年加工原油350万吨以上的现代炼油厂44个。

煤的干馏
把煤隔绝空气加强热使之分解的过程。工业上是把煤放在炼焦炉内,隔绝空气加热到1000-1300℃(高温干馏),使煤分解,得到三部分产物:气体产物-煤气,液体产物-煤焦油,固体产物-焦炭。煤炼焦的意义(综合利用)及规模很大,全世界用于炼焦的煤达数亿吨。用炼焦的方法及一系列吸收、分馏制取焦炭、煤气和氨水、苯、甲苯、二甲苯、萘等化工产品的工业称为炼焦化学工业。由煤炼焦制取基本有机原料示意图如下:

煤的综合利用
煤不仅是一种常用燃料,是热能和动力的主要来源之一,而且可以对它进行化学加工得到大量的基本有机原料。煤的综合利用加工途径主要有:(1)炼焦(干馏),(2)气化,(3)生产电石。用煤炼焦获得各种有机原料(参看煤的干镏),但炼焦只能把煤中的一部分有机物提取出来加以利用,而用气化的方法,则可能利用煤中所含的几乎全部有机物。煤的气化,就是利用空气、水蒸气或其它气体在高温下将煤中的有机物转变成含有CO、CH4、H2等的煤气的一种方法。因为是把固体的煤变成气体,故称煤的“气化”。煤的气化是化学变化。使煤气化的主要目的是将固体燃料转化为气体燃料,可以用管道输送,使用方便,燃烧时清洁,便于控制火焰的温度。煤的气化同时也是获取“合成气”的重要途径,因为CO和H2的混合物可以用来合成甲醇、醛、酮、酸、饱和烃、烯烃、芳香烃、及合成氨等一系列化工产品,比将煤直接燃烧经济上合算得多。我国是世界上煤藏量最丰富的国家之一,煤的综合利用的远景十分可观。1984年我国产煤7.89亿吨,其中用于炼焦约8.2%,气化约5.6%;全国共有大、中、小型焦化厂120多座,焦炉280余台,年产焦炭3900万吨,居世界第四位。这些焦炭用于高炉炼铁的约占55%,用于制合成氨的占13%,用于铸造的占6.7%,用于制电石的占2.8%。与世界先进国家相比,我国的煤化工的规模与新工艺还有待进一步的发展。
聚乙烯

一种热塑性树脂。无毒,具有优良的耐低温性能(最低使用温度可达-100℃),化学稳定性好,能耐酸、碱的腐蚀(氧化性酸除外)。电绝缘性能好,但耐热、耐老化性能差。聚乙烯可用吹塑挤压、注塑成型等方法加工,广泛用于制造薄膜(作为各种食品、医药、化肥、农用薄膜及工业品包装材料)、中空制品(如桶、瓶、贮罐等),纤维(用于生产渔网、绳索)及日用杂品。超高分子量聚乙烯有良好的耐环境应力开裂、低吸湿、耐疲劳、高抗冲击等性能,可用做纺织机械上耐磨、耐冲击的零部件,如皮结齿轮、垫

105Pa,180-200℃)、中压法(1.8-8×105Pa、130-270℃,过渡金属氧化物作催化剂)和低压法(1.4×105Pa,100℃以下TiCl4-Al(C2H5)3为催化剂)三种。低压法可得结晶度高的高密度聚乙烯,有许多特殊用途。
聚氯乙烯

5万到12万。无固定熔点,有较好机械性能和电绝缘性能,对光和热的稳定性差,长时间光照及140℃以上高温会分解产生氯化氢。实际应用中需加入稳定剂,以提高对光和热的稳定性。该树脂耐化学腐蚀,不易着火。注塑时加入适当稳定剂、增塑剂和润滑剂,经加工成型可制成硬质热塑性塑料,以代替金属制成各种工业型材、管材、机械零件、绝缘板、印刷板及防腐材料等;软质热塑性塑料主要用做包装材料和防雨材料;还可制作人造革、地板、录音材料、合成纤维(氯纶)、家具,运动器材等。聚氯乙烯通常是由乙炔在金属卤化物催化下与氯化氢加成制得氯乙烯单体,再经加聚而得:

萘
结构最简单、工业上最重要的稠环芳香烃,分子式C10H8,结构式为:

4.脱水

3.与含氧酸发生酯化反应
CH3CH2OH+HOSO2OH  CH3CH2OSO2OH+H2O
CH3CH2OSO2OH+H2O
2.与氢卤酸反应
CH3CH2OH+HBr→CH3CH2Br+H2O
1.跟活泼金属(K、Mg、Na)反应,置换-OH中H
3.多环芳烃如:

芳香烃主要来源于煤焦油和石油。芳香烃不溶于水,溶于有机溶剂。芳香烃一般比水轻;沸点随分子量的增加而升高。芳香烃易起取代反应,在一定条件下也能起加成反应。如苯跟氯气在铁催化剂条件下生成氯苯和氯化氢,在光照下则发生加成反应生成六氯化苯(C6H6Cl6)。芳香烃主要用于制药、染料等工业。
硝化反应
烃分子中的氢原子被硝基取代生成硝基化合物的反应。硝化剂常使用混酸(浓硝酸与浓硫酸的混合物)。例如:

此外,烷烃也可以经硝化反应生成硝基某烷。例如,甲烷跟硝酸蒸气在加热和加压下生成硝基甲烷。
CH4+HONO2→CH3-NO2+H2O
无色液体
芳香烃的硝基化合物用于制染料、炸药等,烷烃的硝基化合物多用做溶剂。要注意的是,在硝基化合物的分子中,硝基(-NO2)的氮原子是直接连接在碳原子上的,故把三硝基甲苯的结构简式写成:

则是错误的。硝基中氮原子如是通过氧原子间接连接在碳原子上-O-NO2,这是硝酸酯而不是硝基化合物,生成硝酸酯的反应属酯化反应,不属硝化反应。
磺化反应
烃分子中的氢原子被磺酸基(-SO3H)取代生成烃基磺酸的反应。主要是指苯环上的氢原子被-SO3H取代的反应。例如:


磺酸在有机酸中属强酸,羧酸属弱酸。有机物分子中引入磺酸基后,可增加有机物的水溶性。如苯和萘都难溶于水,而苯磺酸和1-萘磺酸却都是溶于水的。
苯的结构
苯分子具有平面的正六边形结构。各个键角都是120°,六角环上碳碳之间的键长都是1.40×10-10米。它既不同于一般的单键(C-C键键长是1.54×10-10米),也不同于一般的双键(C=C键键长是1.33×10-10米)。从苯跟高锰酸钾溶液和溴水都不起反应这一事实和测定的碳碳间键长的实验数据来看,充分说明苯环上碳碳间的键应是一种介于单键和双键之间的独特的键。
为了表示苯分子结构的这一特点,常用下式来表示苯的结构简式  。直到现在,凯库勒式的表示方法仍被沿用,但在理解上绝不应认为苯是单、双键交替组成的环状结构。
。直到现在,凯库勒式的表示方法仍被沿用,但在理解上绝不应认为苯是单、双键交替组成的环状结构。
苯分子里6个碳原子的电子都以sp2杂化轨道相互重叠,形成6个碳碳的σ键,又各以1个sp2杂化轨道分别跟氢原子的1s轨道进行重叠,形成6个碳氢的σ键。
由于是sp2杂化,所以键角是120°,并且所有6个碳原子和6个氢原子都是在同一个平面上相互连接起来的。

苯环上6个碳原子各有1个未参加杂化的2p轨道,它们垂直于环的平面,并从侧面相互重叠而形成一个闭合的π键,并且均匀地对称分布在环平面的上方和下方。通常把苯的这种键型称为大π键。苯的大π键的形成使π键电子云为6个碳原子所共有,因而受到6个碳原子核的共同吸引,彼此结合得比较牢固。同时,苯的大π键是平均分布在6个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的。

催化重整
在加热、加压和有催化剂的作用下,把直馏汽油的直链烷烃的结构进行调整,使它们转化成芳香烃或具有支链的烷烃异构体,以及环烷烃转化成芳香烃的过程,称为催化重整。如:


目前工业上广泛使用的催化剂有铂(Pt)、铼(Re)或同时使用铂和铼。人们根据所使用的催化剂不同,分别称它们为铂重整、铼重整或铂铼重整。直馏汽油经催化重整后,不仅可以制得芳香烃,同时还可以有效地提高燃料汽油的质量。
烃的衍生物
烃分子里的氢原子被其它原子或原子团所取代,生成一系列新的有机物。这些有机物,从结构上说,都可以看做是由烃衍变而来的,所以叫做烃的衍生物。不同的衍生物具有不同的化学性质。烃的衍生物种类很多,如卤代烃、醇、酚、醚、醛、酮、羧酸、酯、硝基化合物等。从结构上看,它们的衍变关系是:

官能团
是有机化合物分子中能够反映特殊性质的原子或原子团。例如,羧酸类

酸性,后者呈碱性。又如醇类分子中的羟基-OH反映醇的特性,烯烃分子中

据之一。重要的官能团如下表:


乙醇的结构
乙醇的分子组成是C2H6O。其分子结构有两种可能,即:

用实验方法可以确定乙醇的分子结构究竟是哪一种:用一定量的无水乙醇,令其跟过量金属钠反应后,测量出所生氢气的体积,再把它换算成标准状况。经过进一步计算,最后结果是每摩乙醇只能生成约0.5摩氢气。由此可知,每个乙醇分子中只有一个氢原子被钠置换。那么,乙醇分子中原子排列顺序只有是上述的右式才是合乎实验结果的。乙醇分子中羟基的氢原子和氧原子间的电子云靠近氧原子,因之使氢原子具有一定程度的离子化倾向,故可被活泼的金属原子(如K、Na、Mg)所置换
醇 类
烃分子里的氢原子(苯环上的氢原子除外)被羟基取代后的生成物。醇的分类方法可有不同标准。按醇分子中羟基数目不同,可分为一元醇、二元醇、三元醇等;按烃基结构不同,可分为饱和醇、不饱和醇、芳香醇,如甲醇CH3-OH,丙烯醇CH2=CH-CH2OH,苯甲醇C6H5CH2OH。若按羟基所连接碳原子的不同,醇可为伯醇(连接羟基的碳原子上还有两个氢原子)、仲醇(连接羟基的碳原子上只有一个氢原子)、叔醇(连接羟基的碳原子上没有氢原子),如CH3-CH2OH(伯醇)、

要注意的是:羟基直接连在苯环上的有机物属酚类,连在其它烃基(链烃基或

低级饱和一元醇为无色中性液体,与水可无限混溶;4-11个碳原子的醇,为无色油状液体,可部分溶于水;高级醇为无色无臭固体,不溶于水。随着分子量的增加,醇的沸点升高。醇的化学性主要是:O-H键断裂;氢原子被代换;C-OH键断裂,羟基被取代或脱去羟基;由于羟基的影响,与羟基相连的碳原子上的氢原子也较活泼。醇的化学性质,可用反应式表示如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com