
4.设NA为阿伏加德罗常数,则下列说法正确的是( )
A.22.4 L乙烯中含有的分子数为NA
B.0.1 L 0.1 mol/L的CH3COOH溶液中含有的分子数为0.01 Na
C.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数0.1Na
D.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等
3.酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理:橙色的K2Cr2O7
酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物
A.②④ B.②③ C.①③ D.①④
2.下列化学名词书写正确的是( )
A.正丁稀 B.硝基笨 C.乙酸乙脂 D.氨基酸
1.据报道,科学家已成功合成了少量O4(其结构式是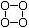 ),有关O4的说法正确的是( )
),有关O4的说法正确的是( )
A.在O4分子中含有极性共价键 B.O4是氧的一种新的同位素
C.相同质量的O4与O3所含原子个数比为4∶3
D.O4与O3、O2都是氧元素的同素异形体
4.元素守恒、电子守恒、电荷守恒
一个正确的氧化还原离子方程式的配平,应同时遵循三个守恒关系,即元素守恒、电子守恒和电荷守恒。
例23:配平方程式:[ ]Sx2-+[ ]BrO3-+[ ]OH-= [ ]SO42-+[ ]Br-+[ ]H2O

3.电荷守恒、电子守恒
例22:在一定条件下,RO3n-和F2可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
解析:设元素R在RO3n-中的化合价为x。
法一:据电荷守恒:n+1×2=1+2×1,n=1。则
x-2×3=-1,x=5。
法二:据电子守恒:(7-x)×1=[0-(-1)]×2,x=5。
2. 元素守恒、电子守恒
元素守恒、电子守恒
例21:用石墨电极电解500mL含KNO3和Cu(NO3)两种溶质的溶液,一段时间后,在两个电极上均生成11.2L气体(标准状况下)。试求:
(1)原溶液中c(Cu2+);
(2)电解后溶液中c(H+)(忽略溶液体积的变化)。
解析:根据题中信息可知:

(1)依据电子守恒: (O2)=
(O2)=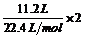 (H2)
+0.5L×c(Cu2+)×2,
(H2)
+0.5L×c(Cu2+)×2,
解得,c(Cu2+)=1.0mol/L。
(2)依据原子守恒可得:Cu(NO3)2~2NO3-~2HNO3~2H+则溶液中c(H+)=2×c(Cu2+)=2.0mol/L。
某些情况下,有的题目可以用不同的守恒关系解决,而有的题目则需要同时运用多种守恒关系方能解决。
1.元素守恒、电荷守恒
例19:向100mL FeCl3溶液中通入标准状况下的H2S 2.24L,待H2S全部被吸收后,再加入过量铁粉,待反应停止后,测得溶液中含有0.6mol金属阳离子,则原FeCl3溶液的物质的量浓度是 。
解析:有关反应:2FeCl3+H2S=2FeCl2+2HCl+S↓,
2FeCl3+Fe=3FeCl2,Fe+2HCl=FeCl2+H2↑
由此不难发现,通入的H2S实际上只相当于分解成了H2和S,对溶液而言并不会产生任何影响,反应前后溶液中恒定不变的是Cl-离子。
法一:据Cl-离子守恒可得:c(Cl-)×0.100L=0.6mol×2,c(Cl-)=0.12mol/L,则c(FeCl3)=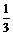 ×c(Cl-)=0.4mol/L。
×c(Cl-)=0.4mol/L。
法二:据反应前后正电荷守恒可得:c(Fe3+)×0.100L×3=0.6mol×2,c(Fe3+)=0.4mol/L,c(FeCl3)= 0.4mol/L。
例20:(2003年新课程卷)将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A.c(HCN)<c(CN-) B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=
c(OH-) D.c(H CN)+c(CN-)=0.1m
CN)+c(CN-)=0.1m ol/L
ol/L
2.电子守恒
例17:容积为30mL的试管中充满了NO2和O2的混合气体,将试管倒立在水槽中,一段时间后,试管中仍然有5mL气体。则原混合气体中NO2和O2的体积比可能是 。
解析:设原混合气体中有amL NO2,则O2为(30-a)mL。
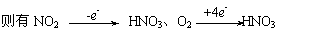 (1)若剩余气体是5mL O2,那么NO2完全转化为HNO3,O2只有(30-a-5)mL=(25-a)mL被还原。
(1)若剩余气体是5mL O2,那么NO2完全转化为HNO3,O2只有(30-a-5)mL=(25-a)mL被还原。
由阿伏加德罗定律和电子守恒得:a×1=(25-a)×4,a=20mL,所以V(NO2) : V(O2)=20mL : (30-20)mL=2:1。
(2) 若剩余气体是5mL NO,则生成5mL NO消耗的NO2为15mL,也就是说有(a-15)mL NO2与(30-a)mLO2反应生成了HNO3。
由阿伏加德罗定律和电子守恒得:(a-15)×1=(30-a)×4,a=27mL,所以V(NO2):V(O2)=27m L:(30-27)mL=9:1。
L:(30-27)mL=9:1。
例18:含ng HNO3的稀硝酸溶液恰好与mg Fe完全反应,若已知有1/4的HNO3被还原成NO,则n:m的取值范围是 。
带电粒子可分为阴、阳离子和电子。在晶体或溶液中,不论有多少种离子,晶体或溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数(电性相反、电量相等),即所谓的电荷守恒;在氧化还原反应或电解池中,氧化剂(或在阴极上)所得电子总数与还原剂(或在阳极上)所失电子总数相等,即所谓的电子守恒。
1.电荷守恒
多用于计算、判断溶液中粒子浓度之间的关系。在有关溶液的计算题中,若没有特别说明,则可忽略H+、OH-的影响;而在讨论溶液中粒子浓度之间的关系时,却必须考虑在内。
例14:将aL由(NH4)SO4和NH4NO3组成的混合溶液分成两等份,一份加入bmol烧碱并加热,刚好把NH3赶出;另一份需消耗含cmol BaCl2的溶液,沉淀刚好完全。则原溶液中c(NO3-)为 。
解析:由题设不难求得aL混合溶液中含2bmol NH4+和2cmol SO42-。依据电荷守恒可得:1×n(NH4+)=2×n(SO42-)+1×n(NO3-),1×2bmol=2×2cmol+1×c(NO3-)×aL,c(NO3-)=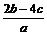 mol/L。
mol/L。
例15:常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中
A.c(HCOO-)>c(Na+)
B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+)
D.无法确定c(HCOO-)与c(Na+)的关系
解析:由电荷守恒可知,c(HCOO-)+c(OH-)= c(H+)+c(Na+),因pH=7,则c(OH-)= c(H+),故c(HCOO-)=c(Na+),选C。
例16:天然的和绝大部分人工制备的晶体都存在各种缺陷,例如某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另
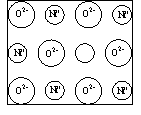 有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电
有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电
中性,但化合物中Ni和O的比值却发生了变化。
某氧化镍样品组成为Ni0.97O。试计算该晶体中Ni3+
与Ni2+的离子数之比。
解析:其解法相当多,在此仅讨论守恒法。
法一:设1molNi0.97O中含Ni3+ xmol,则Ni2+为(0.97-x)mol。据电荷守恒可得,3×xmol+2×(0.97-x)mol=2×1mol,解得x=0.06mol,则Ni3+与Ni2+的离子数之比为:0.06mol:(0.97-0.06)mol=6:91。
法二:据电荷守恒直接分析。依题意“一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,…”从电荷守恒的角度理解:当一个Ni3+取代一个Ni2+后,正电荷增加1[(+3)-(+2)],若要保证晶体呈电中性,就必须再增加一个正电荷,也就是说,每当有一个Ni2+空缺时,需增加两个Ni3+(即取代晶体中的两个Ni2+)。1mol Ni0.97O中空缺0.03mol Ni2+,那么Ni3+应为2×0.03mol=0.06mol。
法三:结合原子守恒。设1mol Ni0.97O中含Ni3+为xm ol,Ni2+为ymol。
ol,Ni2+为ymol。
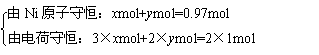
解得:x=0.06mol,y=0.91mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com