
19. 物质的量浓度相同的下列溶液中,按pH由小到大顺序排列的是
A. Na2CO3、NaHCO3、NaCl、NH4Cl
B. NaHCO3、NH4Cl、NaCl、 Na2CO3
C.NaNO3、CH3COONa 、NH4Cl 、NaHSO4
D. NaHSO4 、NH4Cl 、 NaNO3 、 CH3COONa
18.常温时,将pH为5的HCl溶液与pH为2的HCl溶液等体积混合后,溶液的氢氧根离子浓度最接近于
A.2×10-12mol/L B.1/2(10-9+10-12)mol/L C.(10-9+10-12)mol/L D.1/2(10-5+10-2)mol/L
17. 某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质。为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是 A. NaOH B.NH3·H2O C.ZnCO3 D.Fe2O3
16. 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+) B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+) D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
15. 现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是
A.④>③>①=⑤>② B.①=②>③>④>⑤
C.②>①>③>④>⑤ D.④>③>①>⑤>②
14. pH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的pH仍然相同,则X、Y、Z的关系是
A. X=Y=Z B. X<Y=Z C. X>Y=Z D.X=Y<Z
13. 下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①②⑦ B.②③⑤ C.③④⑥ D.①④
12. 下列方程式书写正确的是
A. H2S的电离方程式H2S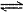 2H++S2-
2H++S2-
B. HCO3-在水溶液中的电离方程式:HCO3-+H2O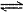 H3O++CO32-
H3O++CO32-
C.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
D. NaHSO4在水溶液中的电离方程式:NaHSO4 Na++H++SO42一
Na++H++SO42一
11. pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.1:9 B.9:1 C.1:11 D.11:1
10. 下列溶液一定呈中性的是
A.pH=7的溶液 B.使石蕊试液呈紫色的溶液
C.c(H+)=c(OH-)=10-6mol/L溶液 D.酸与碱恰好完全反应生成正盐的溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com