
9、某可逆反应2A(g)+3B(g) xC(g)+4D(g),若按下列两组配比:① 0.8 mol A、1.2 mol B、1.2 mol C、2.4 mol D ② 1.4 mol A、2.1 mol B、0.6 mol C、1.2 mol D 分别在容积不变的同一密闭容器中,一定温度下反应达平衡后,C的质量分数相等。化学方程式中x为:
xC(g)+4D(g),若按下列两组配比:① 0.8 mol A、1.2 mol B、1.2 mol C、2.4 mol D ② 1.4 mol A、2.1 mol B、0.6 mol C、1.2 mol D 分别在容积不变的同一密闭容器中,一定温度下反应达平衡后,C的质量分数相等。化学方程式中x为:
A、1 B、2 C、3 D、4
8、已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列相关的三种酸的电离常数,若已知下列反应可以发生: NaCN+HNO2=HCN+NaNO2; NaCN+HF=HCN+NaF;
NaNO2+HF=HNO2+NaF。由此可判断下列叙述不正确的是:
A、K(HF)=7.2×10-4? B、K(HNO2)=4.9×10-10
C、根据两个反应即可能得出酸性强弱的结论 D、K(HCN)<K(HNO2)<K(HF)
7、H2和CO2在高温下发生发应:CO2(g)+H2(g)
CO(g)+H2O(g)。下表是986℃时,在容积不变的密闭容器中进行反应的四组数据:
|
编号 |
起始浓度/mol/L |
平衡浓度/mol/L |
||||||
|
c0(H2) |
c0 (CO2) |
c0 (H2O) |
c0 (CO) |
c(H2) |
c(CO2) |
c(H2O) |
c(CO) |
|
|
1 |
1.0 |
1.0 |
0 |
0 |
0.44 |
0.44 |
0.56 |
0.56 |
|
2 |
1.0 |
2.0 |
0 |
0 |
0.27 |
1.27 |
0.73 |
0.73 |
|
3 |
0 |
0 |
2.0 |
2.0 |
0.88 |
0.88 |
1.12 |
1.12 |
|
4 |
0.2 |
0.4 |
0.6 |
0.8 |
0.344 |
0.544 |
0.456 |
0.656 |
下列叙述中正确的是:
①该温度下反应的平衡常数约为1.6;②该反应的平衡常数与反应的起始浓度无关;③增大CO2的起始浓度,可使CO2的转化率增大;④从反应开始至达到平衡状态,混合气体的密度没有发生改变。
A、②③ B、①②③ C、①②④ D、①③
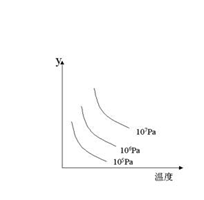
6、某可逆反应L(s) + G(g) 3R(g) ΔH>0,右图表示外界条件温度压强的变化对上述反应的影响。试判断图中Y轴可以表示:
3R(g) ΔH>0,右图表示外界条件温度压强的变化对上述反应的影响。试判断图中Y轴可以表示:
A、平衡混合气中R的质量分数
B、达到平衡时G的转化率
C、平衡混合气中G的质量分数
D、达到平衡时L的转化率
5、在一密闭容器中,反应mA(g) nB(g)达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如右图所示,以下判断正确的是:
nB(g)达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如右图所示,以下判断正确的是:
A、平衡向逆反应方向移动
B、物质B的质量分数增加
 C、物质A的转化率减小
C、物质A的转化率减小
D、化学计量数:m>n
4、已知反应mX(g)+nY(g) qZ(g),该反应正反应放热,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是:
qZ(g),该反应正反应放热,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是:
A、通入稀有气体使压强增大,正反应速率增大
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,平衡将正向移动,X的转化率增大
3、某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);(正反应放热)
2Z(g);(正反应放热)

上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都
没有改变各物质的初始加入量。下列说法中正确的是:
A、t2时加入了催化剂 B、t3时降低了温度
C、t5时增大了压强 D、t4-t5时间内转化率最低
2、若NA表示阿伏加德罗常数,则下列说法正确的是:
A、100℃时水的Kw=1×10-12,此时水电离产生的H+和OH-个数之和为2×10-6NA
B、1L0.1mol/L的盐酸中含有的HCl分子数为0.1 NA
C、1LpH=1的H2SO4溶液中含有的SO2- 4为0.05 NA
D、1molN2和3molH2在有催化剂加热的条件下充分反应生成2 NA个NH3
1、对于化学反应方向的确定,下列说法中正确的是:
A、温度、压强一定时,放热且熵减小的反应一定能自发进行
B、温度、压强一定时,焓因素和熵因素共同决定一个化学反应的方向
C、反应焓变是决定反应能否进行的唯一因素
D、固体的溶解过程与熵变无关
60、(6分)在500mLFe2(SO4)3和CuSO4的混合溶液中加入16.8g的铁粉,搅拌并充分反应后,经过滤、洗涤、干燥,可得到6.4g铜。要使溶液中SO2-4完全沉淀,需加入2.0mol/L的BaCl2溶液500mL。已知Fe3+ 的氧化性比Cu+ 强,求:
(1)原溶液中SO2-4离子的物质的量浓度。
(2)原混合溶液中硫酸铜的物质的量浓度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com