
6. 如图所示为用皮带传动的两个轮子(皮带不打滑),A点为轮O1上边缘处一点,B点为轮O2边缘处一点,则
如图所示为用皮带传动的两个轮子(皮带不打滑),A点为轮O1上边缘处一点,B点为轮O2边缘处一点,则

A.A、B两点的线速度大小一定相等

B.A、B两点的角速度一定相等

C.A、B两点的运动周期一定相等

D.A、B两点的周期、角速度和线速度的大小都不相等

4.现有a、b、c三种单色光,其波长关系为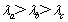 。用b光照射某种金属时,恰好能发生光电效应。若分别用a光和c光照射该金属,则
。用b光照射某种金属时,恰好能发生光电效应。若分别用a光和c光照射该金属,则

A.a光照射时,不能发生光电效应

B.c光照射时,不能发生光电效应

C.a光照射时,释放出的光电子的最大初动能最大

D.c光照射时,释放出的光电子的最大初动能最小

3.人们在研究原子结构时提出过许多模型,其中比较有名的是枣糕模型和核式结构模型,它们的模型示意图如图所示。下列说法中正确的是


A. 粒子散射实验与枣糕模型和核式结构模型的建立无关
粒子散射实验与枣糕模型和核式结构模型的建立无关
B.科学家通过 粒子散射实验否定了枣糕模型,建立了核式结构模型
粒子散射实验否定了枣糕模型,建立了核式结构模型

C.科学家通过 粒子散射实验否定了核式结构模型,建立了枣糕模型
粒子散射实验否定了核式结构模型,建立了枣糕模型

D.科学家通过 粒子散射实验否定了枣糕模型和核式结构模型,建立了波尔的原子模型
粒子散射实验否定了枣糕模型和核式结构模型,建立了波尔的原子模型

2.氘核由1个中子和1个质子组成,若用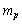 表示质子的静止质量,
表示质子的静止质量, 表示中子的静止质量,
表示中子的静止质量, 表示氘核的静止质量,c表示真空中的光速。则中子和质子结合成氘核时释放出的能量为
表示氘核的静止质量,c表示真空中的光速。则中子和质子结合成氘核时释放出的能量为
A. B.
B.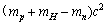


C.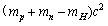 D.
D.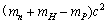


1.下列说法中正确的是
A.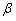 射线比
射线比 射线更容易使气体电离
射线更容易使气体电离
B.核反应堆产生的能量来自轻核的聚变
C. 射线在电场和磁场中都不会发生偏转
射线在电场和磁场中都不会发生偏转
D.太阳辐射的能量主要来源于太阳内部重核的裂变
28.(7分)
工业上生产硫酸,其中重要的一步反应是:


(1)生产中为同时提高反应速率和SO2的转化率,下列措施可行的是 (填字母)。
A.向装置中充入过量的SO2 B.向装置中充入过量的O2
C.使用更高效的催化剂 D.升高温度
(2)在某温度时,10L密闭容器中充入4 mol SO2和2 mol O2,10 min后达平衡。并放出352.8 kJ热量,此时SO2的转化率是
;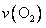 mol/(L·min),平衡常数K=
。
mol/(L·min),平衡常数K=
。
(3)硫酸工业尾气中二氧化硫含量超过0.055%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况)时,碘水恰好褪色。通过计算用数字说明该尾气能否直接排放
。
(已知: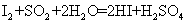 )
)


27.(10分)
硅及其化合物是重要的非金属材料。从石英砂制取高纯硅的主要化学反应有:
粗硅的制取:①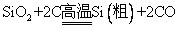
粗硅中 与
与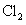 反应:②
反应:②
粗硅的提纯反应:③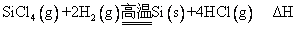
(1)上述三个反应都属于 (填反应类型)。
(2)上述反应涉及的物质中有一种用于制备普通玻璃,写出一个制备普通玻璃的化学方程式 。实验室盛放碱液的试剂瓶用橡皮塞而不用玻璃塞,原因是 (用离子方程式表示)。
(3)已知l mol 固体中有2 mol
固体中有2 mol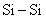 键,1mol O2中有1mol O=O键,l mol SiO2固体中有4 mol Si-O键。
键,1mol O2中有1mol O=O键,l mol SiO2固体中有4 mol Si-O键。
某些化学键数据如下:
|
化学键 |
 |
 |
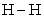 |
 |
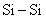 |
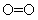 |
断键所需能量/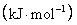 |
460 |
243 |
436 |
431 |
176 |
498 |
请回答下列问题:
Si(s)在O2中完全燃烧生成SiO2的热化学方程式:
。
(4)可由反应②和另一个反应
(填化学方程式)通过盖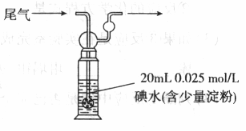 斯定律计算获得反应③的反应热,若该反应每生成I mol化合物的反应热
斯定律计算获得反应③的反应热,若该反应每生成I mol化合物的反应热 kJ/mol,则反应③的反应热
kJ/mol,则反应③的反应热 kJ/mol(用含
kJ/mol(用含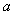 、
、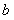 的代数式表示)。
的代数式表示)。
26.(9分)
碘化钠是实验室中常用的分析试剂。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
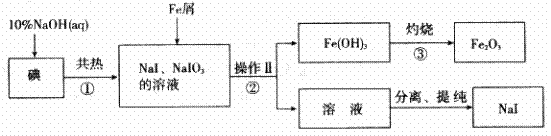
(1)操作II的名称是 。
(2)①反应的离子方程式是 。
②反应的化学方程式是 。
(3)如果③反应是在实验室完成,所用到的仪器有: 、三脚架、泥三角、玻璃棒、 、坩埚钳、火柴、药匙等。
(4)判断①反应中碘是否已完全反应的实验方法是
。
25.(7分)
某无色溶液可能含有以下离子: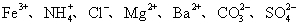 ,现取三份各100 mL进行如下实验,回答相关问题:(不考虑溶液中极少量的
,现取三份各100 mL进行如下实验,回答相关问题:(不考虑溶液中极少量的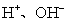 )
)
I.第一份加入AgNO3溶液有沉淀产生。
II.第二份加足量NaOH溶液加热后,收集到气体0.07 mol。
III.第三份加足量BaCl2溶液后,经过滤、洗涤、干燥得沉淀6.27 g。再经足量盐酸洗涤、
干燥后,沉淀质量为2.33 g,(相对分子质量:BaCO3 197; BaSO4 233)
根据上述实验回答:
(1)一定不存在的离子是 。
(2)溶液中肯定存在的阳离子及其浓度(可不填满):
离子符号 ,浓度 mol/L。
离子符号 ,浓度 mol/L。.
(3)甲同学认为还需要另取100mL溶液,加人足量Ba(NO3)2溶液,过滤后,在滤液中再加足量AgNO3溶液,看有无沉淀,如有,并对沉淀称量,才能确定 的存在与浓度,而乙同学认为不需再做实验已能确定溶液中
的存在与浓度,而乙同学认为不需再做实验已能确定溶液中 的存在与浓度,你认为乙同学的看法是否正确
的存在与浓度,你认为乙同学的看法是否正确
(填“是”或“否”),简述其理由: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com