
3. 在出席十一届全国人大一次会议的2 987名代表中,省级政府组成部门领导干部代表比上届减少了1/3;一线工人代表比上届增加了一倍以上;基层农民代表比上届增加了70%以上。这一显著的“增”与“减”说明
①人大代表的结构进一步优化 ②人大代表素质得到切实提高
③我国直接选举的范围在不断扩大 ④人大代表的广泛性
A.①④ B.②③ C.①③ D.②④
2. 2008年4月,湖南省颁布《湖南省行政程序规定》(以下简称《程序规定》),并于2008年10月起施行。这部行政机关“自捆手脚”的程序规则,开全国先河,在地方政府改革中走在前面。此前,制定《行政程序法》的呼声已喊了十余年。在今年的全国人代会上,一份尽快制定《行政程序法》的议案,引起众多代表排队签名附议的轰动。“这是一部政府自己约束自己行为的法律。”议案领衔人、国家行政学院副院长陈伟兰代表这样告诉媒体。此材料可提供的信息包括
A.省级政府是我国的立法机关
B.全国人大代表拥有提案权、立法权
C.健全法制是对权力进行有效制约和监督的唯一途径
D.政府的权力必须依法行使
1. 我国是人民民主专政的社会主义国家,实现人民当家作主的根本途径是
A.保证人民直接行使国家权力 B.人大代表切实履行政府赋予的各项职权
C.完善基层群众自治制度 D.坚持和完善人民代表大会制度
6.等物质的量的NaHCO3和KHCO3的混合物9.20g与100mL盐酸反应。
(1)试分析,欲求标准状况下生成的CO2的体积时,还需什么数据 (用a、b等表示,要注明单位)。
(2)利用所确定的数据,求标准状况下生成的CO2的体积:
|
|
所需数据的取值范围 |
生成CO2的体积(标准状况) |
|
盐酸不足时 |
|
|
|
盐酸过量时 |
|
|
(3)若NaHCO3和KHCO3不是等物质的量混合,则9.2g固体与盐酸完全反应时,在标准状况下生成CO2气体的体积大于 L,小于 L 。
5.在周期表中,元素的相对原子质量约为其原子序数的2-2.6倍。某碱金属(R)及其氧化物(R2O)组成的混合物4.0 g与水充分反应后,蒸发结晶得到固体5.0 g 。试推断这是什么金属?混合物中碱金属单质所占的质量分数是多少?
4.常温下A和B两种气体组成的混合气体(A的分子量大于B的分子量),经分析混合气中只含有氮和氢两种元素,而且,不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确认A为①____,B为②____,其理由是③____。若上述混合气体中氮和氢的质量比为7:1,则在混合气中A和B的物质的量之比为④____;A在混合气中的体积分数为⑤____。
3.由第二主族元素R的单质及其相应氧化物组成的混合物共12g,在此混合物中加足量水,完全反应后,蒸干,得固体。则该元素可能为 ( )
A.Mg B.Ca C.Sr D.Ba
2.800°C时,将1molCO和1molH2O(g)通入2L密闭容器中进行反应:
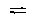 CO(g)+H2O(g) CO2(g)+H2(g)
CO(g)+H2O(g) CO2(g)+H2(g)
达到平衡时,测得容器内CO2为0.3 mol/L,此时再向容器内通入1mol H2O(g),并保持温度不变,则达到平衡时CO2的物质的量可能是( )
A.0.3mol B. 0.6mol C. 0.9mol D. 1.2mol
1.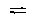 PCl5在密闭容器中有反应:PCl5(g) PCl3 (g)
+Cl2 (g)。t1°C时PCl5的分解率为48.567%,t2°C时分解率为97.034%。则t2°C时反应体系的物质的量是t1°C时反应体系的多少倍( )
PCl5在密闭容器中有反应:PCl5(g) PCl3 (g)
+Cl2 (g)。t1°C时PCl5的分解率为48.567%,t2°C时分解率为97.034%。则t2°C时反应体系的物质的量是t1°C时反应体系的多少倍( )
A.0.4 B. 1.3 C. 1.6 D. 1.9
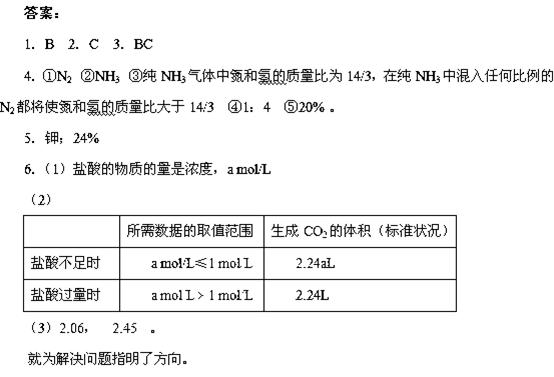
5.4 / x = 8 /(x
+17) , x =
35.7
x = 8 /(x
+17) , x =
35.7
设5.4 g全部是R2O,则R的原子量为 y 。则R的摩尔质量为 y g / mol。
2 ×{ 5.4/(2y + 16)}= 8/(y + 17) , y = 10.7
因为10.7 ﹤ 23 ﹤ 35.5 ,故R为Na 。
总结:采用极限值,可使该题中的复杂问题得到简化。
例8 :1.40 g含有碱金属(M)及其氧化物(M2O)的混合物,与水反应生成1.79 g碱。求混合物的成分及其组成。
方法:由于碱金属不确定,可用极端假设法加以讨论。即讨论1.40 g全部为碱金属及1.40 g全部为碱金属氧化物时生成碱的质量,然后根据平均值规律建立不等式解题。

解得 x=0.498(g)
y=0.902(g)
总结:本题若用常规法对可能存在的物质作逐一尝试,逐一淘汰求解是很繁难的。选取极值法进行求解,可受到事半功倍的效果。
例9 :在标准状况下H2和Cl2的混合气体a L,经光照后完全反应,所得气体恰好能使b mol 的NaOH完全转化为盐,则a,b的关系不可能是下列的( )。
A.b =
a/ 22.4 B.b ﹥a/22.4
C.b ≥a/11.2 D.b﹤a/22.4
22.4 B.b ﹥a/22.4
C.b ≥a/11.2 D.b﹤a/22.4
方法:“气体恰好能使b mol 的NaOH完全转化为盐”是该题的关键之处。“气体恰好”是指能与NaOH反应的气体能完全与之反应并转化为盐,而不是气体无剩余(可能剩余H2)。以此可用极限法去分析,即NaOH的最小值为a L全为H2,NaOH的最大值为a L全为Cl2。
解析:若a L全为H2时,耗碱量为0,若a L全为Cl2时耗碱量最大,此时b = a/11.2 。因此对二者的混合气体而言,耗碱量应介于0 - a/11.2之间,故a,b关系不可能的只有C 。
总结:此题在分析时,不仅要考虑极限值,还要考虑题中关键字词。
例10 :某混合物含有KCl、NaCl、Na2CO3,经分析知含Na
31.5%,含氯为27.08%(质量百分含量)。则该混合物中含Na2CO3为 (  )
)
A. 25% B. 50% C. 80% D.无法确定
方法:若假设此混合物由下列三种物质的极端组成,那么判断起来比较简单。
(1)若只由KCl和Na2CO3组成,用含Na%求出Na2CO3的质量
(2)若只由NaCl和Na2CO3组成,又用含Cl%量求出Na2CO3的质量
(3)若只由KCl和Na2CO3组成,用Cl%量求出Na2CO3的质量
混合物中Na2CO3的实际质量应比(1)(2)中值小,比(3)中值大(因KCl比NaCl分子量大)
解析:设混合物为100 g:
(1) 设混合物只由KCl和Na2CO3组成,则用含Na%求出Na2CO3的质量为:
100g×31.5%× 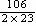 =
72.6g
=
72.6g
(2)  设混合物只由NaCl和Na2CO3组成,则用含Cl%量求出Na2CO3的
设混合物只由NaCl和Na2CO3组成,则用含Cl%量求出Na2CO3的 质量为
质量为
100g- 100g×27.08% × = 55.4g
(3) 设混合物只由KCl和Na2CO3组成,则用含Cl%求出Na2CO3的质量为:
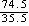 100g-
100g- 100g×27.08%× =
43.2g
100g×27.08%× =
43.2g
因为 72.6g﹥55.4g﹥50g﹥43.2g
故正确答案为(B)
总结:对于三种物质,两种数据,如通过列方程求解,因缺少数据而无法求得结果。此时必须要考虑极限问题,通过分析极限情况而获得正确结果。
 例11 :800℃时将1 mol CO和1
mol H2O(蒸气)通入2 L密闭容器中进行反应:CO(g)+ H2O(g) CO2(g)+H2(g),达到平衡时测得容器内CO2为0.3 mol/L,此时再向容器内通入1 mol水蒸气,并保持温度不变,则达到平衡时CO2物质的量可能为( )
例11 :800℃时将1 mol CO和1
mol H2O(蒸气)通入2 L密闭容器中进行反应:CO(g)+ H2O(g) CO2(g)+H2(g),达到平衡时测得容器内CO2为0.3 mol/L,此时再向容器内通入1 mol水蒸气,并保持温度不变,则达到平衡时CO2物质的量可能为( )
A.0.9 mol B.0.6 mol C.0.3 mol D.1.2 mol
方法:通过找出新平衡时CO2物质的量的范围,再进行估算即可。
解析:由于反应是可逆的,反应物不可能完全转化,因此再向容器内通入1 mol水蒸气时,CO2的物质的量应大于0.6mol,但CO又不可能完全转化为CO2,所以CO2的物质的量应介于0.6 - 1 mol之间,故选 A 。
总结:此类试题如果通过计算,则必须要懂得化学平衡常数,而在此条件下,想通过计算获得结果根本不可能,以此只能通过估算获解。
专项训练:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com