
18.
(1) ;
(2) ;
(3) ;
(4) 。
21.(12分)现有一盛有无色固体物质M的试剂瓶,标签已破损(如图所示),请根据已有知识,对该试剂可能是什么物质作出猜想,并根据其性质回答下列问题:
 (Ⅰ) 猜想
(Ⅰ) 猜想
M可能的化学式为(填序号)( )
A.Na2S B.Na2SiO3 C.Na2HPO4 D.高氯酸钠
(Ⅱ) 性质预测
(1)若M是“候氏制碱法”的产品,写出反映M溶液中电荷守恒的关系式: ;
(2)某学生猜测M可能是硫代硫酸钠(Na2S2O3),他在M溶液中滴加稀硫酸,溶液变浑浊,再滴入品红溶液,品红褪色,试写出该反应的化学方程式: ;如果有0.1mol Na2S2O3完全反应,则反应中电子转移的物质的量是 ;
(3)若M置于空气中被氧化成另一种物质时,其相对分子质量只增加16,写出向酸性高锰酸钾溶液中逐渐滴加M溶液,高锰酸钾被还原成锰离子(Mn2+)时反应的离子方程式: 。
 “华安、连城、永安、漳平、泉港一中,龙海二中”六校联考
“华安、连城、永安、漳平、泉港一中,龙海二中”六校联考
2010-2011学年上学期第一次月考高三化学试卷答题卷
20.(12分)
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
|
阳离子 |
Na+、Al3+、Ba2+、NH4+ |
|
阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下 ①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题 (1)A所含的阴离子的电子式是 ,B所含的阳离子的结构示意图是 ; (2)写出③中生成气体的离子方程式 ;
(3)C的化学式是 ,
(4)简述D溶液呈碱性的理由
。
19.(13分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体CuSO4·5H2O)。其实验方案如下:
(1)所加试剂①、②分别是 , ;
(2)把氯化铝溶液蒸干并充分灼烧得到的固体物质是 ;
(3)从滤液E中得到绿矾晶体的实验操作步骤是:在隔绝空气的条件下,
,过滤、洗涤、干燥;
从滤渣F制取胆矾的第一步操作最好采用(填序号)( );
A.和浓硫酸直接加热反应 B.在空气中灼烧
C.和硫酸铁溶液反应 D.蒸发结晶
(4)上述制取物质的实验方案中,有一步设计明显不合理,请你予以指出,并说明理由。不合理之处: ,理由是 。
18. (12分)置换反应的通式可表示为:
(12分)置换反应的通式可表示为:
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为
;
(2)若过量的单质甲与化合物A发生反应的化学方程式为:
2Al+Fe2O3  Al2O3+2Fe。
Al2O3+2Fe。
除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出用单质乙做碱性(KOH溶液)燃料电池反应物时的负极反应式 ;
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为 。
17.炼金厂的废水中含有CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是( )
A.CN-可以和稀硫酸反应生成HCN
B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被Br- 还原
D.NaCN溶液中离子浓度大小顺序为C(Na+)> C(CN-)> C(OH-)> C(H+)
16.过氧化氢俗称双氧水,它是一种液体,在催化剂的作用下,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂。为贮存、运输、使用的方便,工业常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3 ·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是( )
A.NaHCO3 B. SO2
C.稀盐酸 D.MnO2
15.25℃时,水的电离达到平衡:H2O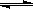 H++OH;ΔH>0,下列叙述正确的是( )
H++OH;ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
14.酸碱恰好完全发生中和反应时( )
A.酸和碱的物质的量一定相等
B.酸所提供的H+与碱提供的OH-的物质的量相等
C.酸和碱的物质的量浓度相等 D.溶液一定呈中性
13.在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c,则下列说法正确的是( )
A.所得溶液呈无色 B.最后得到的溶液中一定含有Cu2+
C.将残余固体加入到稀H2SO4中,有气泡产生 D.最后得到的溶液中可能含有Fe3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com