
9.(14分)学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、____________、____________、____________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、______、_____。
(2) 实验编号3的实验中KClO3的分解率为_________%(保留一位小数)。
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用________________试纸检验。上述异常现象产生的原因是______________________________________________。
VI 实验结论:____________________________________________________________。
8. 一定温度下,有可逆反应:2A(g)+2B(g)
一定温度下,有可逆反应:2A(g)+2B(g)  C(g)+3D(g);
C(g)+3D(g);
ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC
和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如
图所示),保持反应过程中两容器的温度与起始时相同。下列说
法正确的是
A.甲、乙两容器中的反应达到化学平衡时,两容器内压强相等
B.甲、乙两容器中的反应达到化学平衡时,C的体积分数相等
C.向甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度不变
D.向乙容器中再充入2molC和6molD,平衡后乙中物质C的浓度为原来的2倍
7.在一密闭容器中充入2molA和lmolB发生反应:2A(g)+B(g)  xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、C 1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
xC(g),达到平衡后,C的体积分数为W%,若维持容器的容积和温度不变,按起始物质的量A 0.6mol、B 0.3mol、C 1.4mol充入容器达到平衡后,C的体积分数仍为W%。则下列叙述中正确的是
A.平衡时A 、B的物质的量之比一定为2:1 B.x的值可能是2,也可能是3
C.平衡时A 的物质的量与原平衡一定相等 D.C的体积分数不可能为W%
6.某温度下,在容积固定的密闭容器中可发生可逆反应A(g)+2B(g) 2Q(g),平衡时,各物质的量浓度比为c(A)∶c(B)∶c(Q)=1∶1∶2,保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
2Q(g),平衡时,各物质的量浓度比为c(A)∶c(B)∶c(Q)=1∶1∶2,保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
A.刚充入时反应速率v正减少,v逆增大
B.达到新的平衡时,反应混合物中A、B的物质的量分数增加
C.达到新的平衡时,c(A)∶c(B)∶c(Q)仍为1∶1∶2
D.达到新的平衡过程中,体系压强先增大,后逐渐减小
5.根据下列有关图象,说法不正确的是

A.由图象Ⅰ知,该反应在T1、T3处达到平衡,且该反应的△H<0
B.由图象Ⅱ知,该反应在t5阶段NH3体积分数最大
C.图象Ⅲ是在10L容器中850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
D.由图象Ⅳ知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L
4.在一密闭容器中有如下反应:aX(g)+bY(g) nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH=Q。某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
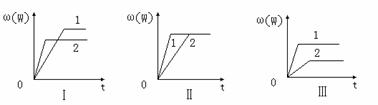
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,ΔH<0
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
3.在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g) 2C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
2C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是
|
|
X |
Y |
|
A |
再加入A |
B的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
缩小体积 |
A的转化率 |
|
D |
升高温度 |
混合气体密度 |
2. 下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
Ni(s) + 4CO(g)  Ni(CO)4(g)
Ni(CO)4(g)
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A.纯Ni(s)和Ni(CO)4(g) B.纯Ni(s)和CO(g)
C.不纯Ni(s)和CO(g) D.不纯Ni(s)和Ni(CO4)(g)
1.在一定温度下容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O (g) CO(g)+H2 (g)。下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2 (g)。下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是
A.体系的压强不再发生变化
B.V正(CO)=V逆(H2O)
C.生成n molCO的同时生成n mol H2
D.1 mol H-H键断裂的同时断裂2 molH-O键
函数是中学数学的重要内容,函数方程思想贯穿中学数学的始终,利用函数方程思想可以解决很多数学问题,因此历年的高考试题多贯穿着函数及其性质这条主线,结合最新的考试说明及近两年的高考命题趋势,我认为2009年将继续贯穿这条主线,主要考察为:
(1) 考察重点仍是函数概念、性质及应用。
(2) 考察热点是函数模型的应用,函数的图象和性质。
(3) 仍可能以函数为背景,以导数为工具,与不等式、解析几何知识交汇点命题。
(4)
重视分段函数和一元二次方程根的分布问 题
题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com