
为纪念中华人民共和国成立60周年,中国人民银行于2009年9月16日发行建国60周年金银纪念币一套。该纪念币破例以纯金纯银铸造,更是体现了其作为建国60周年核心藏品的价值,尚未上市,就备受投资者追捧,在各大城市未卖先火,预定、咨询电话打爆。据此回答1-2题。
1.发行中华人民共和国成立60周年金银纪念币,对中国人民银行来说:
①实现了其价值 ②实现了其使用价值
③出让了其价值 ④出让了其使用价值
A.①③ B. ②③ C. ①④ D.②④
2.该套纪念币共5枚,其中金币3枚,银币2枚,均为中华人民共和国法定货币。该套纪念币在本质上是:
A. 一般等价物 B.纸币 C.铸币 D. 商品
13.(14分)
(1) Xe + 3 F2 === Xe F6(2分)
(2)550(500-550范围内均可得分)(1分) 850(800-850范围内均可得分)(1分)
(3)>(1分) 随着温度的升高,Xe F6(g) Xe F4 (g) + F2 (g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的ΔH>0。(2分)
Xe F4 (g) + F2 (g)平衡向右移动,根据温度升高平衡向吸热反应方向移动的原理,则该反应的ΔH>0。(2分)
(4)Xe F6 、Xe F4 、Xe F2 、Xe 、F2(3分)
(5)
Xe (g) + F2(g)  XeF2(g)
XeF2(g)
起始浓度(mol/L): 0.125 1.225 0
转化浓度(mol/L): c(XeF2) c(XeF2) c(XeF2)
平衡浓度(mol/L):0.125-c(XeF2) 1.225-c(XeF2) c(XeF2)
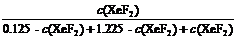 =0.08 (2分)
=0.08 (2分)
c(XeF2)= 0.1mol/L (2分)
12.(8分)
(1)770℃(2分),890℃(2分) (2)降低压强或移去钾蒸气,适当升高温度(2分)
(3)K=c(K)/c(Na)(2分)
11.(12分)
(1) 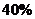 (3分) (2) A中X的转化率>B中X的转化率。(3分)
(3分) (2) A中X的转化率>B中X的转化率。(3分)
(3) 2.6aL(3分)
(4)变大(1分); 升高温度,平衡逆向移动,但温度升高使气体的体积增大,气体浓度减小,平衡向正向移动,且压强不变时,气体体积与温度成正比,为线性关系,是体积变化的主要原因。(2分)
10.(12分)
(1) K= (2分); 减小(2分)。 (2)
(2分); 减小(2分)。 (2) 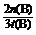 mol·(L·min)-1(2分)。
mol·(L·min)-1(2分)。
(3) b; c。 (3分) (4)
Cu2O+CO 2Cu+CO2。(3分)
2Cu+CO2。(3分)
9.(14分)
课题名称:探究氧化铁、氧化铜、氧化铬对氯酸钾受热分解反应的催化作用,(或二氧化锰、氧化铁、氧化铜、氧化铬催化能力的比较)。其他合理也给分 (2分)
实验仪器及试剂:大试管(1分)、 酒精灯(1分)、 计时器(或秒表) (1分);
实验讨论:
(1) 普通漏斗(1分);烧杯 (1分) (2) 40.8 (2分)
(3) Cl2(1分); 湿润的碘化钾淀粉试纸(1分); KClO3与Cr2O3 发生了氧化还原反应 (1分)
VI 实验结论:氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂或氧化铁的催化能力和二氧化锰的催化能力较好。其他合理也给分(2分)
13.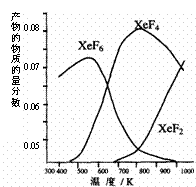 (14分)Xe和F2在不同温度下反应可得XeF6、
(14分)Xe和F2在不同温度下反应可得XeF6、
XeF4和XeF2三种氟化物,下图表述的是将0.125mol/L
Xe和1.225mol/L F2为起始反应物,在一个体积固定的
容器内发生反应,得到的生成物在平衡体系内的物质的
量分数与反应温度的关系。
(1)420K时,发生反应的化学方程式为:
_________________________________。
(2)制备XeF6和XeF4最适宜的温度分别约为
__________K和__________K。
(3)600-800K时,会发生反应:
XeF6(g) XeF4(g)+ F2(g),其反应热△H _______0(填“>”“=”或“<”)。理由是______________________________________________________________
XeF4(g)+ F2(g),其反应热△H _______0(填“>”“=”或“<”)。理由是______________________________________________________________
。
(4)900K时,容器中存在的组分有_________________________________。
(5)若在某温度下,反应只生成XeF2,其物质的量分数为0.08,求反应混合物中XeF2的浓度。(写出计算过程)
2009高三化学专题训练(16)(化学平衡)
12.(8分)钾是-种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:Na(l)+KCl(l) NaCl(l)+K(g)(ΔH >0),各物质的沸点与压强的关系见下表。
NaCl(l)+K(g)(ΔH >0),各物质的沸点与压强的关系见下表。
|
压强(kPa) |
13.33 |
53.32 |
101.3 |
|
K的沸点(℃) |
590 |
710 |
770 |
|
Na的沸点(℃) |
700 |
830 |
890 |
|
KCl的沸点(℃) |
|
|
1437 |
|
NaCl的沸点(℃) |
|
|
1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转 化率可以采取的措施是
。
(3)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为:K= 。
11.(12分)如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g);∆H<0达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g);∆H<0达到平衡时V(A)=1.2aL。试回答:
 (1)A中X的转化率为
。
(1)A中X的转化率为
。
(2)A、B中X转化率大小关系为A B
(填“>”、“<”、“=” )
(3)打开K,一段时间后又达到新的平衡时,
A的体积为 L(连通管中气体体积不计)
(4)在(3)达到平衡后,同时等幅升高A、B的温度,达到平衡后,A的体积
(填变大、不变、或变小),其理由是
。
10.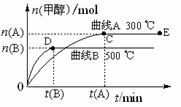 (12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),根据题意完成下列各题:
CH3OH(g),根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,
升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率
v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 。。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________________(用方程式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com