
29.归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1) 硒的熔点范围可能是___________ (2) 碲的化合价可能有_________________
(3) 硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是_________________(填化学式),
其中H2S的电子式为
(4) 氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为__________________________________。
(5) 工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
( )A12Te3+( ) 一( )A1(OH)3↓+( )H2Te↑
(6)已知在常温下,H2和S反应生成17g H2S气体放出56.1KJ的热量,
 试写出硫化氢气体分解的热化学方程式:
试写出硫化氢气体分解的热化学方程式:
_______________________ __________
(7) 右图为氧族元素单质与H2反应过程中的能量变化示意图,
其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同
物质的量的单质与H2反应的反应热。则:b代表
________________,d代表_____________(均写单质名称)。
28.⑴ 在右面元素周期表中画出
金属元素与非金属元素的分界线。
⑵ 有人认为形成化合物最多的
元素不是IVA族的碳元素,而是
另一种短周期元素,请你根据学
过的化学知识判断这一元素是
__________。
⑶ 现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①写出甲的元素符号 其在元素周期表中对应的位置
② 甲、乙两元素相比较,金属性较强的是_______(填名称), 可以验证该结论的实验是__________。(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
27. 实验室欲配制80mL 1.4mol/L的NaNO3溶液,试回答:

(1) 用不到的仪器是: ;
A.烧杯 B.500mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F.100mL容量瓶
(2) 配制时应称取NaNO3 g;
(3)下列操作的顺序是(用字母表示) ;
A.放置至室温 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配得溶液无影响的是(写序号) ;会使所配溶液的浓度偏大的是 ;会使所配溶液的浓度偏小的是 。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
B.未将洗涤烧杯内壁的溶液转移入容量瓶;
C.容量瓶中所配的溶液液面未到刻度线便停止加水;
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;
F.将容量瓶中液面将达到刻度线时,俯视刻度线和液面。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
26.某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI。
(1)用这五种物质组成一个合理的未配平的方程式:
(2)若水是产物,请配平该反应的方程式,并标出电子转移方向与数目: 。
(3)pH为5-9时,体系中的氧化反应为HI→I2;当pH < 4时,反应方向改变,此时体系中的氧化反应为:_______ → ________。
25. 第三周期元素x,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外
层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.x元素最高价氧化物对应的水化物一定是强酸
B.x的单质在固态时一定属于原子晶体
C.x的单质一定是良好的半导体材料
D.x元素在常温下稳定存在的氧化物一定能与烧碱反应
II卷 非选择题
24.下列结论错误的是( )①微粒半径:K+>Al3+>S2->C1-
②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I- ④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.只有① B.①③ C.②④⑤⑥⑦ D.①③⑤
23.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是( )
A.食盐和葡萄糖分别溶解在水中 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.液溴和苯分别受热变为气体
22. 下列电子式中错误的是
A.
Na+ B. 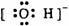 C.
C. 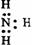 D.
D. 
21.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
20.设NA为阿佛加德罗常数,下列叙述中正确的是( )
A. 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
B.标准状况下22.4 L H2 中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D. 26 g 苯和乙炔混合气体中含有分子数为NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com