
10.常温下,0.1 mol·L-1某一元酸(HA)溶液中 =1×10-8,下列正确的是( )
=1×10-8,下列正确的是( )
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.0.1mol/L的NaA溶液中的离子浓度大小关系为:c(Na+)>c(A-) >c(H+)>c(OH-)
C.该溶液中水的离子积常数为1×10-22
D.用0.1 mol·L-1NaOH溶液V1 L 与0.1 mol·L-1该一元酸(HA)V2 L溶液混合,若混合溶液的pH = 7,则V1<V2
9.下列溶液中各微粒的浓度关系正确的是( )
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c(NH4)2SO4>c(NH4HSO4)>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液:c(Na+)>c( HCOO-) >c(H+) >c(OH-)
C.某二元弱酸的酸式盐:c(H+)+c(Na+) =c(A2-)+c(HA-) +c(OH-)
D.1.0mol/LNa2CO3溶液:c(OH-) = c(H+)+c(H2CO3) +c(HCO3-)
8.下列各组离子,在所给的条件下能够大量共存的是( )
A.在pH=0的溶液中:Fe2+ Mg2+ SO42- NO3-
B.由水电离出的c(H+)=1×10-12mol/L的溶液中:HCO3- K+ Na+ S2-
C.在AlCl3溶液中:SO32- Na+ CO32- AlO2-
D.在滴加酚酞试液后呈红色的溶液中:I- Na+ S2- AlO2-
7.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大 小。按照“酸碱质子理论”,下列说法正确的是( )
A.2Na + 2H2O=2NaOH + H2↑是酸碱反应
B.ClO-+ H2O HClO
+ OH-是酸碱反应
C.碱性强弱顺序:OH->ClO->CH3COO-
HClO
+ OH-是酸碱反应
C.碱性强弱顺序:OH->ClO->CH3COO-
D.HCO3-既是酸又是碱,NH3既不是酸又不是碱
6.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2 B.Cl- C.Fe3+ D.NO3 ¯
5.下列关于反应能量的说法正确的是 ( )
A.CaCO3(s)=CaO(s)+CO2(g);△H=+187.5kJ·mol-1,E反应物>E生成物
B.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);
△H=-216kJ·mol-1,E反应物>E生成物
C.H1(g)=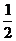 H2(g)+
H2(g)+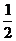 I2(s);△H=+25.6kJ·mol-1,HI在密闭容器中分解后放出26.5kJ的能量
I2(s);△H=+25.6kJ·mol-1,HI在密闭容器中分解后放出26.5kJ的能量
D.H+(aq)+OH(aq)=H2O(1);△H=-57.2kJ·mol-1,含1molNaOH水溶液与含0.5molH2SO4的浓硫酸混合后放热57.2kJ
4.运用元素周期定律分析下列推断,其中错误的是 ( )
A.铍是一种轻金属,它的氧化物的水化物可能具有两极
B.砹单质是一种有色固体,砹化氢很不稳定,砹化银是有色难溶于水且感光性很强的
固体
C.硫酸锶是难溶于水的白色固体
D.硒化氢是无色、有毒,比硫化氢更稳定的气体
3.下列各组离子在溶液中能大量共存的是 ( )
A.A1O2、CO32、C1、K+ B.S2、OH、C1O、Na
C.Fe2+、NH4+、SO42、S2 D.Fe3-、SCN、Na、C1
2.下列说法中正确的是(NA表示阿伏加德数常数) ( )
A.1molC12与其他物质完全反应,转移的电子数一定是2NA
B.标准状况下,1L已烷所含碳原子个数约为6NA/22.4
C.3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA
D.17gNH3所含电子数为10NA
1.美国哥伦比亚大学的科学家根据对沉积物质中稀土元素钕(Nd)的分析发现,北大西洋和太平洋海水中的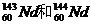 比例差异很明显,由此得出周围大陆的岩石中
比例差异很明显,由此得出周围大陆的岩石中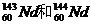 含量不同的结论。下列有关说法正确的是 ( )
含量不同的结论。下列有关说法正确的是 ( )
A.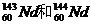 互为同素异形体
互为同素异形体
B.因各地的岩石中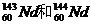 含量不同,所以Nd没有固定的相对原子质量
含量不同,所以Nd没有固定的相对原子质量
C.上述结论可以用于研究洋流从一个海盆流到另一个海盆时海水的混合状况
D.Nd是镧系元素,镧系元素都互为同位素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com