
31. 判断下列有关化学基本概念的依据正确的是( )
A. 共价化合物:是否含有共价键 B. 强弱电解质:溶液的导电能力的大小
C. 酸性溶液:pH<7 D. 氧化还原反应:元素化合价是否变化
30.如下图,在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器。在Ⅰ、Ⅱ中分别加入2 mol A和2 mol B,起始时容器体积均为V L,发生如下反应并达到化学平衡状态: 2A十B xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是( )
xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是( )
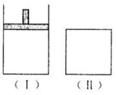
A.x的值为2
B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同
D.平衡时,Ⅰ容器的体积小于V L
29.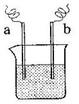 右图中,两电极上发生的电极反应为:
右图中,两电极上发生的电极反应为:
a极:Cu2+ + 2 e-= Cu b极:Fe - 2 e-= Fe2+
下列说法中不正确的是( )
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
28.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
D.N3¯与CO2含相等电子数
27.用惰性电极电解硫酸铜和盐酸的混合溶液,电解一段时间后停止通电,下列说法正确的是( )
A.阴极质量一定增加
B.通电时电子从阴极经外电路流入阳极
C.相同条件下,阳极产生的气体的体积一定比阴极大
D.相同条件下,阳极产生的气体的体积一定比阴极小
26.在下列实验中,不能达到目的的是( )
A.用金属钠分别与水和乙醇反应,确定水和乙醇分子中羟基氢(-OH)的活泼性强弱
B.用石墨做电极,电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱
D.根据Na2CO3和Na2SO3水溶液酸碱性强弱,确定碳和硫两元素非金属性的强弱
24.亚氯酸钠(NaClO2)可做漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时,刚加入硫酸反应缓慢,随后突然反应释放出ClO2,这是因为( )
A.酸使亚氯酸的氧化性增强 B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用 D.逸出的ClO2使生成物浓度降低
|
A.K+浓度减小 B.KMnO4在阳极区生成
C.阴极周围溶液的pH值减小 D.反应过程中共转移0.005mol电子
23.用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4→MnO2+K2O+O2(240℃)。下列说法不正确的是( )
A.每生成11.2 L氧气一定转移了2 mol电子
B.相同质量的KMnO4分解,生成MnO2的反应比生成K2MnO4的反应放出更多氧气
C.O2是氧化产物,MnO2是还原产物
D.在此条件下,KMnO4的氧化性强于O2
22.将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度为( )
A.0.011 mol·L-1 B.0.22 mol·L-1 C.0.022 mol·L-1 D.0.11 mol·L-1
21.从下列实验事实所引出的相应结论正确的是( )
|
选项 |
实验事实 |
结论 |
|
A |
其它条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 |
当其它条件不变时,增大反应物浓度化学反应速率加快 |
|
B |
在化学反应前后,催化剂的质量和化学性质都没有发生改变 |
催化剂一定不参与化学反应 |
|
C |
在常温下N2很难与金属化合 |
氮元素的非金属性很弱 |
|
D |
NaOH晶体不能导电 |
NaOH是非电解质 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com