
2.如图,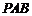 、
、 分别是圆
分别是圆 的割线和切线(C为切点),若
的割线和切线(C为切点),若 ,则
,则 的长为
的长为
 A.
A. B.6
B.6
C.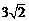 D.3
D.3
1.
函数 的值域为
的值域为
A. B.
B.
C. D.
D.
20.(11分)新型材料纳米α-Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α-Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
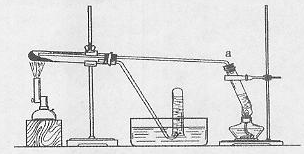
(1)甲同学用下图所示装置进行α-Fe粉与水蒸气的反应。

证明实验中有氢气产生的现象是 。
 (2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
(2)乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物。
①试管a中的物质是 。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
|
实验步骤 |
实验操作 |
实验 现象 现象 |
|
Ⅰ |
将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 |
黑色粉末逐渐溶解,溶 液呈浅绿色;有少量气泡产生 液呈浅绿色;有少量气泡产生 |
|
Ⅱ |
向实验I中得到的溶液滴加几滴KSCN溶液,振荡 |
|
实验现象不能确定是否存在Fe3O4,主要原因是
(用离子 方程式表示)
方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为 mol。
19.(8分)在一条件下,CH3COOH溶液中存在电离平衡:
CH3COOH CH3CH3COO-+H+ △H>0
(1)下列方法中,可以使0.10mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是 。
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH
c.加入稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f加入少 量0.10mol·L-1的NaOH溶液
量0.10mol·L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡为1.75×10-5。现有:
①0.100.010mol·L-1 CH3COOH溶液 ②0.00100.010mol·L-1 CH3COOH溶液
其c(H+)之比为①:②= 。(提示:进行简化计算,平衡时的
c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同)
(3)25℃时,向0.10mol·L-1 CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol·L-1,则溶液中c(H+)= mol·L-1
(计算结果保留小数点后两位有效数字)。溶液中各种离子浓度关系是 。
18.(10分)W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
 (1)W的单质是一种
(1)W的单质是一种  色晶体。
色晶体。
(2)X、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是 。
(用化学式表示,乙的气态氢化物与其同主族元素气态化物化学式写法相似)。
(3)已知A、B、C、D四种物质存在如下反应关系:
A+B→C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是 。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是 。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是 。
17.(9分)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物经燃 烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和位于分子端的C
烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和位于分子端的C C键,核磁共振氢谱有三个峰,峰面积为6:1:1。
(1)A的分子式是 。
(2)下列物质中,一定条件能与A发生反应的是 。
A.H2 B.Na C.KMnO4 D.Br2
(3)A结构简式是 。
(4)有机物B是A的同分异构体,1mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。B的结构简式是 。
14.高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽 车。总反应方程式如下:
车。总反应方程式如下:
|

 NiOOH+MH
NiOOH+MH
下列叙述正确的是 ( )
A.放电时正极附近溶液的碱性增强
B.放电时负极反应为:M+H2O+e=MH+OH-
C.充电时阳极反应为:NiOOH+H2O+e-=Ni(OH)2+OH-
D.放电时每转移1mol电子,正极有1mol NiOOH被氧化
第Ⅱ卷 (非选择题,共58分)
(非选择题,共58分)
 15.(10分)有机物A是常见的有机物,现有如下反应关系
15.(10分)有机物A是常见的有机物,现有如下反应关系
已知:①醛可以发生如下反应:

②B与乙酸酐( )能发生取代反应生成阿司匹林( )
③F为一种可降解高分子聚合物。
(1)A生成D的化学方程式是 。
(2)B分子中的含氧官能团是 。
(3)G的结构简式是 。
(4)E生成F的化学方程式是
 。
。
(5)H与C互为同分异构体,H分子中苯环上取代基与C相同,H的结构简式可能是
。
 16.(10分)实验室用下图所示装置制取乙烯。
16.(10分)实验室用下图所示装置制取乙烯。
(1)①仪器A的名称 ;
②依器B中盛装的试剂是 。
(2)仪器B中盛装的试剂是 。
(3)装入药品前,应检查装置的气密性。检查该套装置气密性的操作是
(4)若在导管口点燃乙稀,观察到的现象是 。
13.上列在限定条件溶液中的各组离子,能够大量共存的是 ( )
A.pH=3 的溶液:Na+、Cl-、Fe2+、ClO-[来源:Z§X§X§K]
B.与Al能产生氢气的溶液:K+、SO 、CO
、CO 、NH4+[来源:ZXXK]
、NH4+[来源:ZXXK]
C.使酚酞试液变红的溶液:Na+、Cl-、SO 、Al3+
、Al3+
D.水电离的H+浓度为1×10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
12.下列根据反应原理设计的应用,不正确的是 ( )
 A.CO
A.CO +H2O
HCO3-+OH- 热的纯碱溶液清洗油污
+H2O
HCO3-+OH- 热的纯碱溶液清洗油污
 B.Al3++3H2O
Al(OH)3+3H+
明矾净水
B.Al3++3H2O
Al(OH)3+3H+
明矾净水
 C.TiCl4+(x+2)H2O(过量)
TiO2·xH2O↓+4HCl
C.TiCl4+(x+2)H2O(过量)
TiO2·xH2O↓+4HCl
 D.SnCl2+H2O
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
D.SnCl2+H2O
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
11.已知:2CO(g)+O2(g) 2CO2(g) △=-566kJ·mol-1
N2(g)+O2(g) 2NO(g) △=+180kJ·mol-1
则2CO(g)+2NO(g) N2(g)+2CO2(g)
的△是
A.-386 kJ·mol-1
B.+386 kJ·mol-1
C.-746 kJ·mol- 1
1
D.+746 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com