
15.下列离子方程式中正确的是
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:
Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++
OH- NH3↑+ H2O
NH3↑+ H2O
C.稀硝酸和过量的铁屑反应:3 Fe + 8H+ +2 NO3- = 3 Fe3+ +2 NO↑ + 4 H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ =2 H2O + I2
14.短周期元素X、Y、Z,其中X、Y位于同一主族,Y、Z位于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列比较正确的是
A.元素非金属性:Z> Y > X B.最高价氧化物水化物酸性:Z > Y
C. 原子半径:Z < Y < X D.气态氢化物的稳定性:Z < Y < X
13.下列说法正确的是
A.2.24 L CO2中含有的原子数为0.3×6.02×1023
B.1.8 g NH4+ 含有的质子数为6.02×1023
C.30 g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023
D.7.8 g Na2O2中含有的阴离子数为0.2×6.02×1023
12.下列相关实验不能达到预期目的的是
|
|
相关实验 |
预期目的 |
|
A. |
相同温度下,等质量的大理石块、大理石粉分别与等体积、等浓度的盐酸反应 |
探究接触面积对化学反应速率的影响 |
|
B. |
把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 |
探究温度对化学平衡的影响 |
|
C. |
在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 |
探究蔗糖水解产物具有还原性 |
|
D. |
两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入FeCl3溶液 |
探究FeCl3溶液对H2O2分解速率的影响 |
11.已知Ca(OH)2的溶解度随温度升高而降低。将40℃的饱和澄清石灰水冷却至l0℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是
A.溶液中Ca2+的数目 B.溶剂的质量
C.溶液中溶质的物质的量浓度 D.溶质的质量
10.已知下列热化学方程式:
Zn(s) + 1/2 O2(g)= ZnO(s) ΔH= -351.1 kJ·mol-1
Hg(l) + 1/2 O2(g)= HgO(s) ΔH= -90.7 kJ·mol-1
由此可知Zn(s)+ HgO(s)= ZnO(s)+ Hg(l)的反应热ΔH为
A.-260.4 kJ·mol-1 B.+260.4 kJ·mol-1 C.- 441.8 kJ·mol-1 D.+ 441.8 kJ·mol-1
9.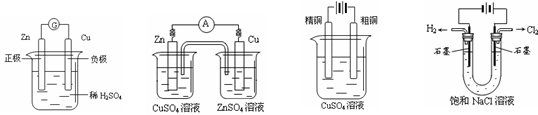 下图有关电化学的示意图正确的是
下图有关电化学的示意图正确的是
A. B. C. D.
8.下列叙述不正确的是
A.酒精和硝酸银溶液均能使蛋白质变性
B.乙烯和二氧化硫均能使酸性KMnO4溶液褪色
C.水晶项链、光导纤维、玻璃、瓷器等都是硅酸盐制品
D.反应AgBr + KI = AgI + KBr能在水溶液中进行,是因为AgI比AgBr更难溶于水
7.三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3 NF3 + 5 H2O = 2 NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
6.室温下,水的电离达到平衡:H2O 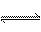 H+ + OH-。下列叙述正确的是
H+ + OH-。下列叙述正确的是
A.将水加热,平衡向正反应方向移动,Kw不变
B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com