
94. (1)氧化反应 缩聚反应
(1)氧化反应 缩聚反应  (2)
(2)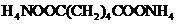
(3)

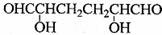 (4)
(4)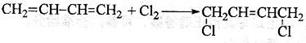

 (5) d
(5) d (6)
(6) (合理即给分)
(合理即给分)
95
96
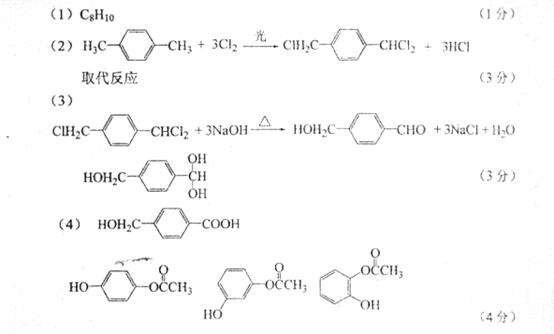
 97
97

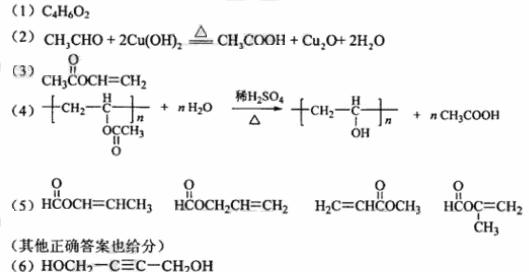
 98 (1)C11H13O4N
98 (1)C11H13O4N  (2)甲醛
(2)甲醛
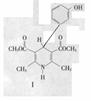
 (3)
(3)




 (4)B、C
(4)B、C

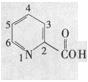
 (5)
12
(5)
12
99
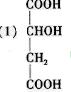
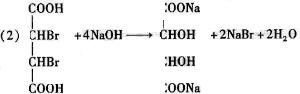
(3)7
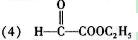
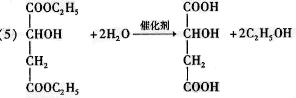

100 (1)C4H10。
(2)2-甲基-1-氯丙烷、2-甲基-2-氯丙烷
(3)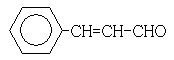
(4)消去反应。
(5)
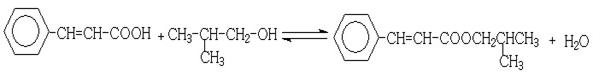
(6) 、
、 、
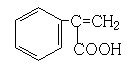
、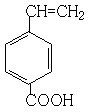 、
、
76.
(1)N≡N
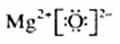
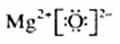
第4周期,第Ⅷ族
(2)① ③
(3)CH4 NH3
NH3+H3O+=NH+4+H2O
(4)3SO2+2NO-3+3Ba2++2H2O=3BaSO4?+2NO+4H+
SO2

 77
77
③32
78 (1)为了防止亚铁化合物被氧化
(2)CO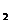 H
H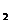 O NH3
O NH3
(3)Fe+H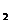 P
P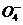 +Li+
+Li+ 2e
2e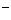 =LiFePO4+2H+
=LiFePO4+2H+
(4)
(5)FePO4+Li++e ====LiFePO4
====LiFePO4
79 (1)①氯气;a;d;浓硫酸
(2)①SiCl4+2H2+O2 SiO2+4HCl②0.35 (3)134.4
SiO2+4HCl②0.35 (3)134.4
 80 (1)反应物能量 生成物能量
80 (1)反应物能量 生成物能量
(2)无 降低 因为催化剂改变了反应的历程使活化能E降低
(3)-198
(4) SO2 +V2O5=SO3+2VO2 4VO2+ O2=2V2O5 (4)0.025 0.05
 (5) S(s)+O2(g)
=2SO2(g)
△H1=-296 KJ·mol-1
(5) S(s)+O2(g)
=2SO2(g)
△H1=-296 KJ·mol-1
SO2(g)+1/2O2(g) =SO3(g) △H2=-99 KJ·mol-1
 3 S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185 KJ·mol-1
3 S(s)+9/2O2(g)=3SO3(g) △H=3(△H1+△H2)=-1185 KJ·mol-1
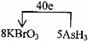
 81:
81: (1)AsH3
(1)AsH3 (2)Br2
(2)Br2 (3)a c
(3)a c  (4)
(4)
 82(1)B
82(1)B
 (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4
的溶解度,有利于K2SO4 析出。
(3)降低K2SO4
的溶解度,有利于K2SO4 析出。
 (4)2SO42-
-2e-
(4)2SO42-
-2e- 2S2O82-
2S2O82-
83(1)C (2)D
(3) 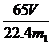 (或
(或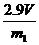 等其他合理答案:)
等其他合理答案:)
(4)金属锌的密度(或其他合理答案:)(5)偏大
(6)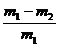 (或其他合理答案:)(7)劣于
(或其他合理答案:)(7)劣于
 84 (1)Fe + 2Fe3+ = 3Fe2+
84 (1)Fe + 2Fe3+ = 3Fe2+
 (2)加入硫酸,H+浓度增大,使Fe2+ + 2H2O
(2)加入硫酸,H+浓度增大,使Fe2+ + 2H2O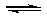 Fe(OH)2
+ 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
Fe(OH)2
+ 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
 (3)Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O
(3)Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O
 4FeCO3 +
6H2O + O2 = 4Fe(OH)3 ↓+ 4CO2
4FeCO3 +
6H2O + O2 = 4Fe(OH)3 ↓+ 4CO2
 (4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
 (5)288.0
(5)288.0
 85(1)取少量上层清液,滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3 沉淀完全。
85(1)取少量上层清液,滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3 沉淀完全。
 (2)防止溶液吸收空气中CO2
(2)防止溶液吸收空气中CO2
 (3)①酸式滴定管
(3)①酸式滴定管
 ②99.9%
②99.9%
 ③样品中存在少量的NaCl 少量的CaCl2
.2H2O失水
③样品中存在少量的NaCl 少量的CaCl2
.2H2O失水
 86(1)2NH4AlO(OH)HCO3
86(1)2NH4AlO(OH)HCO3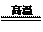 Al2O3+3H2O+2CO2↑+2NH3↑
Al2O3+3H2O+2CO2↑+2NH3↑
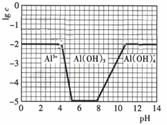
 (2)①4.5g ②再向烧杯中加入100mL蒸馏水,充分搅拌至固体溶解
(2)①4.5g ②再向烧杯中加入100mL蒸馏水,充分搅拌至固体溶解
 (3)① H++OH-=H2O NH4++
OH—= NH3·H2O Al3++3OH—=Al(OH)3↓;
(3)① H++OH-=H2O NH4++
OH—= NH3·H2O Al3++3OH—=Al(OH)3↓;
②


 87(1)固体NH4Cl和Ca(OH)2
87(1)固体NH4Cl和Ca(OH)2
 2NH4Cl +Ca(OH)2
CaCl2+2NH3↑+2H2O(或其他合理答案)
2NH4Cl +Ca(OH)2
CaCl2+2NH3↑+2H2O(或其他合理答案)
 (2)碱石灰(或CaO) 除去NH3气流中的水汽
(2)碱石灰(或CaO) 除去NH3气流中的水汽
(3)黑色粉末部分逐渐变为红色 2NH3+3CaO N2+3H2O+3Cu
(4)出现无色液体 氨水
用红色石蕊试纸检验、试纸变蓝 用无水硫酸铜检验,无水硫酸铜变蓝
 88(1)关闭活塞,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,说明装置气密性良好。
88(1)关闭活塞,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,说明装置气密性良好。
 (2)防止反应过程中空气进入反应管,便于观察N2的逆流
(2)防止反应过程中空气进入反应管,便于观察N2的逆流
 (3)熄灭酒精灯,待反应管冷却至室温,停止通入氮气,并关闭活塞。
(3)熄灭酒精灯,待反应管冷却至室温,停止通入氮气,并关闭活塞。
 (4)①2.80 ②产物中生成了CaO,x的值偏小
(4)①2.80 ②产物中生成了CaO,x的值偏小
89 I.(1)容量瓶
(2)2 5 6 2 8 502
(3)酸式
滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色
(4)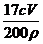
(5)偏高
II.
|
实验内容 |
实验方法 |
实验现象 |
|
验证氧化性 |
取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液。 (取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液。) |
产生淡黄色沉淀或 溶液变浑浊。 (溶液变蓝色。) |
|
验证不稳定性 |
取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验。 (取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中。) |
产生气泡,木条复燃。 (溶液变浑浊或有浅 黄色沉淀产生) |
90
 91(1)土壤(根系吸收)
91(1)土壤(根系吸收)
汽车尾气含铅,离公路距离不同,空气中含铅量不同
(2)①近地面不同高度空气含铅量的研究
②离地面越低(高),含铅量越高(低) 铅和铅化合物密度大。
(3)①烧杯 漏斗 ②烘干 偏高 (4)C
92  (1)①
(1)①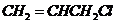 碳碳双键、氯原子 ②取代反应
碳碳双键、氯原子 ②取代反应

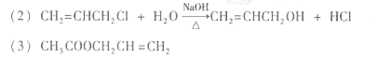
 (4)a c d
(4)a c d
 (5)蒸馏
(5)蒸馏


 93(1)取代反应 加成反应
93(1)取代反应 加成反应
 (2)
(2)
 (3)
(3)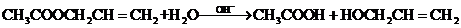
 (4)3
(4)3
70.(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O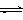 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
71:(1)分子,干冰 (2)正四面体,非极性 Si3N4 (3)三角锥形,
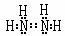
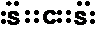 (4)
(4)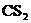 和CCl4
非极性分子
和CCl4
非极性分子
72

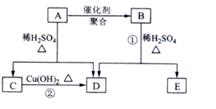
73(1)原子晶体。(2)NO2和N2O4 (3)As2S5。
(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
74:
(1) (2)弱于(3)S + 2H2SO4(浓)
(2)弱于(3)S + 2H2SO4(浓) 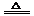 3SO2↑+ 2H2O
3SO2↑+ 2H2O
(4)2H2O2 MnO22H2O + O2↑(或其他合理答案:)(5)NaNO2 (6)(3a – 4b)KJ/mol
75:

68、⑴白色沉淀→灰绿色→红褐色沉淀(2分)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(2分)
⑵3Fe + 2NO3- + 8H+ = 3Fe2+ + 2NO↑ + 4H2O(2分)
⑶不能 由③知:2HNO3 + NO = 3NO2 + H2O。在浓硝酸中不可能生成NO(4分)
69:(1)D为FeSO4(2分),E为H2S (2分)
(2)离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SO42-(2分)
(3)离子方程式2Cu2++2H2O 2Cu+4H++O2↑(2分)
2Cu+4H++O2↑(2分)
(4)称一定量的Cu2S和CuS充分燃烧,再称燃烧后的产物,若燃烧后的质量和反应物的质量相等,则被燃烧的物质是Cu2S,若燃烧后的质量比原来的反应物质量少,则被燃烧的物质是CuS。(2分)
65、(1)H2+S H2S(写成可逆反应也正确)(2)H2SO3
+ 2H2S=3S + 3H2O
H2S(写成可逆反应也正确)(2)H2SO3
+ 2H2S=3S + 3H2O
(3)C+2H2SO4(浓) CO2 ↑+2SO2 ↑+2H2O
CO2 ↑+2SO2 ↑+2H2O
或Cu+ 2H2SO4(浓) CuSO4 +SO2 ↑+ 2H2O等
CuSO4 +SO2 ↑+ 2H2O等
(4)①H2SO3 +2OH— = SO32— + 2H2O②大于;Na2SO3溶液中SO32-发生水解使溶液显碱性。
③增大;升高温度促进Na2SO3溶液的水解。
66(1)CaC2、CaO、CO2、Ca(OH)2、C2H2、.(2)Ca(OH)2+CO2=Ca(HCO3)2
 (3)
(3)
67
⑴0.200 mol(不带单位不给分)⑵Cl2+2OH-=Cl-+ClO-+H2O(4分)
⑶C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
⑷NH4++HCO3-+2OH- NH3↑+CO32-+2H2O(或:NH4++HSO3-+2OH-
NH3↑+CO32-+2H2O(或:NH4++HSO3-+2OH- NH3↑+SO32-+2H2O,或:NH4++HS-+2OH-
NH3↑+SO32-+2H2O,或:NH4++HS-+2OH- NH3↑+S2-+2H2O,其它正确答案亦可)(6分)
NH3↑+S2-+2H2O,其它正确答案亦可)(6分)
⑸4HCl+NaAlO2=NaCl+AlCl3+2H2O(或:4H2SO4+2NaAlO2=Na2SO4+Al2(SO4)3+4H2O,注:若H2SO4写成硝酸亦可)(3分)
100.(09全国卷Ⅰ30) 化合物H是一种香料,存在于金橘中,可用如下路线合成:
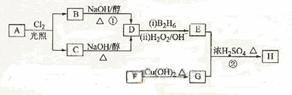
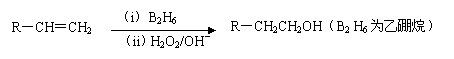
已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。
A的分子式是________________。
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为__________。
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3-苯基-1-丙醇。F的结构简式是_____________。
(4)反应①的反应类型是__________________。
(5)反应②的化学方程式为________________________。
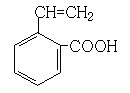
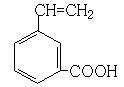
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:
__________________________________。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
D |
B |
D |
D |
B |
C |
D |
C |
B |
A |
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
A |
C |
A |
D |
A |
A |
A |
B |
A |
B |
|
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
C |
C |
B |
D |
C |
C |
C |
C |
C |
C |
|
31 |
32 |
33 |
34 |
35 |
36 |
37 |
38 |
39 |
40 |
|
B |
D |
A |
D |
A |
B |
B |
D |
C |
C |
|
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
|
D |
D |
C |
A |
A |
B |
B |
A |
D |
A |
|
51 |
52 |
53 |
54 |
55 |
56 |
57 |
58 |
59 |
60 |
|
C |
C |
C |
B |
B |
B |
B |
B |
C |
C |
 61 (1)Cu2(OH)2CO3
[Cu(OH)2·CuCO3]或CuCO3
61 (1)Cu2(OH)2CO3
[Cu(OH)2·CuCO3]或CuCO3 
 (2) C>O
(2) C>O
 (3)CH2OH(CHOH)4CHO +
2Cu(OH)2
(3)CH2OH(CHOH)4CHO +
2Cu(OH)2  CH2OH(CHOH)4COOH
+ Cu2O↓+ 2H2O
CH2OH(CHOH)4COOH
+ Cu2O↓+ 2H2O
 医学上可用这个反应检验尿液中的葡萄糖
医学上可用这个反应检验尿液中的葡萄糖
 (4)3Cu2O + 14HNO3
(4)3Cu2O + 14HNO3  6Cu(NO3)2
+ 2NO↑+ 7H2O
6Cu(NO3)2
+ 2NO↑+ 7H2O
 (5)金刚石、石墨、富勒烯(C60)或碳纳米管等
(5)金刚石、石墨、富勒烯(C60)或碳纳米管等
 62 (1)Al C Na2O2
62 (1)Al C Na2O2
(2) 2H2O +Na2O2 =4NaOH+O2↑ 2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
 (3) CO2 CO
(4) Na2CO3 (5) 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
(3) CO2 CO
(4) Na2CO3 (5) 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
 63 (1)
63 (1)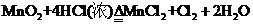
 (2)
(2)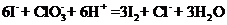
 (3)
(3)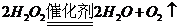 或
或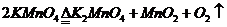
64(1)三 II A 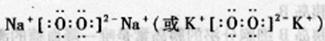
(2)水分子之间存在氢键且比硒化氢的分子间作用力强
(3)
(4)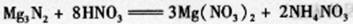 (5)2
(5)2
99.(09四川卷28)四川汶川盛产品质优良的甜樱桃。甜樱桃中含有一种羟基酸(用A表示),A的碳链结构无支链,化学式为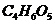 ;1.34 g
A与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。A在一定条件下可发生如下转化:
;1.34 g
A与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。A在一定条件下可发生如下转化:
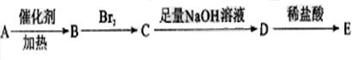
 其中,B、C、D、E分别代表一种直链有机物,它们的碳原子数相等。E的化学式为
其中,B、C、D、E分别代表一种直链有机物,它们的碳原子数相等。E的化学式为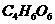 (转化过程中生成的其它产物略去)。
(转化过程中生成的其它产物略去)。
已知:
A的合成方法如下:
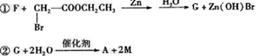
其中,F、G、M分别代表一种有机物。
请回答下列问题:
(1)A的结构简式是_____________________。
(2)C生成D的化学方程式是 。
(3)A与乙醇之间发生分子间脱水反应,可能生成的有机物共有 种。
(4)F的结构简式是 。
(5)写出G与水反应生成A和M的化学方程式: 。
98.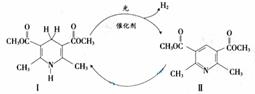 (09广东化学
(09广东化学 26)
26) 光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为
光催化制氢是化学研究的热点之一。科学家利用含有呲啶环(呲啶的结构式为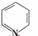 ,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物II作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):



 (1)化合物II的分子式为_____________。
(1)化合物II的分子式为_____________。
 (2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);
(2)化合物I合成方法如下(反应条件略,除化合物III的结构未标明外,反应式已配平);

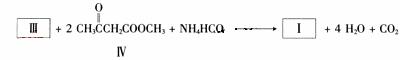
 化合物III的名称是________________。
化合物III的名称是________________。
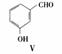
 (3)用化合物V(结构式见右图)代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为___________________。
(3)用化合物V(结构式见右图)代替III作原料,也能进行类似的上述反应,所得有机产物的结构式为___________________。
 (4)下列说法正确的是_____________(填字母)
(4)下列说法正确的是_____________(填字母)
 A. 化合物V的名称是间羟基苯甲醛,或2-羟基苯甲醛
A. 化合物V的名称是间羟基苯甲醛,或2-羟基苯甲醛
 B. 化合物I具有还原性;II具有氧化性,但能被酸性高锰酸钾溶液氧化
B. 化合物I具有还原性;II具有氧化性,但能被酸性高锰酸钾溶液氧化
 C. 化合物I、II、IV都可发生水解反应
C. 化合物I、II、IV都可发生水解反应
 D. 化合物V遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
D. 化合物V遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
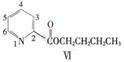
 (5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见上图,其合成原料2-呲啶甲酸的结构式为_________________;VI的同分异构体中,呲啶环上只有一个氢原子被取代的呲啶甲酸酯类同分异构体有_________________种。
(5)呲啶甲酸酯可作为金属离子的萃取剂。2-呲啶甲酸正丁酯(VI)的结构式见上图,其合成原料2-呲啶甲酸的结构式为_________________;VI的同分异构体中,呲啶环上只有一个氢原子被取代的呲啶甲酸酯类同分异构体有_________________种。
97. (09全国卷Ⅱ
(09全国卷Ⅱ 30)
30)
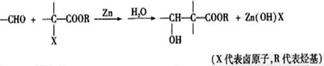
 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:

 已知R-CH=CHOH(烯醇)不稳定,很快转化为
已知R-CH=CHOH(烯醇)不稳定,很快转化为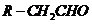 。
。

 根据以上信息回答下列问题:
根据以上信息回答下列问题:

 (1) A的分子式为
;
(1) A的分子式为
;

 (2) 反应②的化学方程式是
;
(2) 反应②的化学方程式是
;

 (3) A的结构简式是
;
(3) A的结构简式是
;

 (4) 反应①的化学方程式是
(4) 反应①的化学方程式是

 (5) A有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:
、
、
、
(5) A有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:
、
、
、
 ;
;

 (6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为

 。
。
96. (09海南卷
(09海南卷
 18-4)以下是某课题组设计的合成聚酯类高分子材料
18-4)以下是某课题组设计的合成聚酯类高分子材料
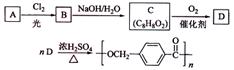
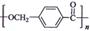 的路线:
的路线:
 已知:
已知:
 ①A的相对分子质量小于110,其中碳的质量分数约为0.9;
①A的相对分子质量小于110,其中碳的质量分数约为0.9;
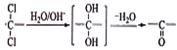
 ②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
 ③C可发生银镜反应。
③C可发生银镜反应。
 请根据以上信息回答下列问题:
请根据以上信息回答下列问题:
 (1)A的分子式为
;
(1)A的分子式为
;
 (2)由A生成B的化学方程式为
,反应类型是
;
(2)由A生成B的化学方程式为
,反应类型是
;
 (3)由B生成C的化学方程式为 ,该反应过程中生成的不稳定中间体的结构简式应是
;
(3)由B生成C的化学方程式为 ,该反应过程中生成的不稳定中间体的结构简式应是
;
 (4)D的结构简式为
,D的同分异构体中含有苯环且水解产物之一为 乙酸的有
(写结构简式)。
(4)D的结构简式为
,D的同分异构体中含有苯环且水解产物之一为 乙酸的有
(写结构简式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com