
26、(13分)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验
(1) 请完成以下实验设计表(表中不要留空格)。
|
实验 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
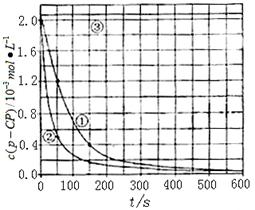
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
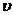 (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(4)实验③得出的结论是:PH等于10时, 。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
25、(12分)重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还含有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:

请回答下列问题。
⑴若Ⅰ中只用一种试剂调节溶液的pH,应选用 (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑵Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是
(用离子方程式表示)。
⑶Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 氧化还原反应(填“是”或“不是”),反应的平衡常数表达式K= 。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Ag2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 。
24、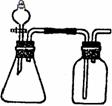 (9分)Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中
(9分)Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中
尾气处理装置略)的是 (填序号)。
① 石灰石和稀盐酸 ② 二氧化锰和浓盐酸
③ 铜和稀硝酸 ④ 铜和浓硫酸
⑤ 浓盐酸和浓硫酸 ⑥ 铝和烧碱溶液
Ⅱ、联氨(N2H4)及其衍生物是一类重要的火箭燃料。
N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g)
△H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)
△H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
N2O4(g)达到平衡。
其他条件不变时,下列措施能提高NO2转化率的是 (填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
Ⅲ、 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O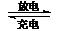 Cd(OH)2
+ 2Ni(OH)2
Cd(OH)2
+ 2Ni(OH)2
(3)该电池充电时阳极反应式:
(4)放电时负极附近溶液的碱性 (填“增强”或“减弱”或“不变”)
23、(12分)短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数。其中X是形成化合物种类最多的元素。Y固体单质与盐酸反应,再向反应后的溶液中加入一定量的烧碱溶液,最终溶液中有白色沉淀Q生成。Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液。W的最高价氧化物形成的水化物在自然界中酸性最强 填写下列空白:
填写下列空白:
(1)X的最高价氧化物的结构式为
(2)写出生成白色沉淀Q的化学方程式 ,
已知298K时,该物质的的Ksp=5.6×10-12,若此时测得溶液PH=13.00,则此温度下残留在溶液中的Y离子物质的量浓度为 。
(3)Z元素的氧化物溶于浓NaOH溶液的离子方程式:
(4)写出W单质的一种用途 。
(5)Y、Z、W四种元素的原子半径由大到小的顺序为 (用元素符号表示)
22、已知某可逆反应mA(g)+nB(g)  qC(g) △H ,在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象判断
qC(g) △H ,在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象判断
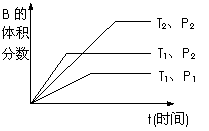 A.T1>T2,
△H>0, P1>P2, m+n>q
A.T1>T2,
△H>0, P1>P2, m+n>q
B.T1>T2, △H>0, P1<P2, m+n<q
C.T1<T2, △H<0, P1>P2, m+n>q
D.T1>T2, △H<0,,P1<P2, m+n>q
第Ⅱ卷(非选择题 共56 分)
21、今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Cl-、Mg2+、Ba2+、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.K+一定存在 B.100 mL溶液中含0.01 mol CO32 -
C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在
20、下列说法不正确的是
A.用NaOH溶液就可鉴别K+、Al3+、Mg2+三种离子
B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该物质一定含有NH4+
C.pH试纸测得新制氯水的pH为4
D.用已知物质的量浓度的盐酸来测定未知浓度的烧碱溶液,酸式滴定管未用标准盐酸润洗,会使所测烧碱溶液浓度偏高。
19、下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。

在上述实验过程中,所涉及的三次分离操作分别是
A.蒸馏 过滤 分液 B.分液 蒸馏 蒸馏
C.蒸馏 分液 分液 D.分液 蒸馏 结晶、过滤
18、下列实验能达到预期目的的是
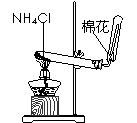
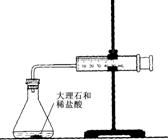
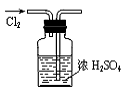
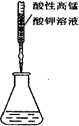
A.干燥Cl2 B.滴定FeSO4溶液 C.测定一定时间内CO2 的体积 D.实验室制氨气
17、在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y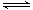 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com