
4.对称法(又称等效氢法) 判断方法如下:
(1)同一C 原子上的氢原子是等效
(2)同一C 原子所连甲基上的氢原子是等效氯
(3)处于镜面对称位置上的氢原子是等效
有机物燃烧规律小结
有机物燃烧的规律是中学有机化学基础中的常见题型,也是高考化学中的热点内容,许多学生对这些知识点往往容易产生混淆,现将其归纳总结如下:
有机物完全燃烧的通式: 烃: CxHy+(x+y/4)O2→xCO2+(y/2)H2O 烃的衍生物: CxHyOz+(x+ y/4 - z/2)O2→xCO2+(y/2)H2O
题型一:有机物的质量一定时 1.烃类物质(CxHy)完全燃烧的耗氧量与成正比。 2.有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中含碳或氢的质量分数一定;若混合物总质量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的物质的量保持不变,则混合物中各组分含碳或氢的质量分数相同。 3.燃烧时耗氧量相同,则两者的关系为:⑴同分异构体 或 ⑵最简式相同。 例1. 下列各组有机物完全燃烧时耗氧量不相同的是 A.50g乙醇和50g甲醚 B.100g乙炔和100g苯 C.200g甲醛和200g乙酸 D.100g甲烷和100g乙烷 解析:A中的乙醇和甲醚互为同分异构体,B、C中两组物质的最简式相同,所以答案为D。 例2.下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是 A.甲烷、辛醛 B.乙炔、苯乙烯 C.甲醛、甲酸甲酯 D.苯、甲苯 解析:混合物总质量一定,不论按什么比例混合,完全燃烧后生成CO2的质量保持不变,要求混合物中各组分含碳的质量分数相同。B、C中的两组物质的最简式相同,碳的质量分数相同,A中碳的质量分数也相同,所以答案为D。 例3. 分别取等质量的甲烷和A(某饱和一元醇)、B(某饱和一元醛)、C(某稠环芳香烃含氧衍生物),若它们完全燃烧,分别生成了物质的量相同的CO2 .则: (1)A的分子式为_______;B的分子式为_______,C的分子式为_________(C的分子式有多种可能,只写分子量最小的一种)。 (2)写出符合上述要求时,CH4和A、B、C的分子组成必须满足的条件是__________(以n表示碳原子数,m表示氧原子数,只写通式)。 解析:A、B、C中的碳的质量分数与甲烷中相同,(1)中A、B的分子式只要结合醇、醛的通式就可以求出答案。稠环芳香烃中最简单的是萘,通过增加氧原子维持含碳的质量分数不变可推出C .(2)的通式推导抓住每少16个氢原子增加一个氧原子即可。 答案:(1)A、C9H20O B、C8H16O C、C10H8O2
(2)CnH4n-16mOm
题型二:有机物的物质的量一定时
1. 比较判断耗氧量的方法步聚:①若属于烃类物质,根据分子中碳、氢原子个数越多,耗氧量越多直接比较;若碳、氢原子数都不同且一多一少,则可以按1个碳原子与4个氢原子的耗氧量相当转换成碳或氢原子个数相同后再进行比较即可。②若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为CxHy·(H2O)n或CxHy·(CO2)m或CxHy·(H2O)n·(CO2)m形式,再按①比较CxHy的耗氧量。
2.有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中碳原子或氢原子的个数一定;若混合物总物质的量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的量保持不变,则混合物中各组分中碳或氢原子的个数相同。
例4. 相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是
A.C3H4和C2H6
B.C3H6和C3H8O
C.C3H6O2和C3H8O D.C3H8O和C4H6O2
解析:A中C3H4的耗氧量相当于C2H8,B、C、D中的C3H8O可改写为C3H6·(H2O),C中的C3H6O2可改为C3H2·(H2O)2,D中的C4H6O2可改为C3H6·(CO2),显然答案为B、D。
例5. 1molCxHy(烃)完全燃烧需要5molO2,则X与Y之和可能是
A、X+Y=5
B、X+Y=7 C、X+Y=11 D、X+Y=9
解析:根据烃燃烧通式可知,1molCxHy的耗氧量为 ,讨论易知,当x=3,y=8时合理,答案为C。
例6. 有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数) ( )
A.8n
B.14n
C.18n
D.44n
解析: A中的一个碳原子被B中的四个氢原子代替,A和B的分子量相差8的倍数,即答案A. 如果A和B的分子组成相差若干个H2O或CO2 ,耗氧量也不变,即分别对应答案C和D。
题型三:一定量的有机物完全燃烧,生成的CO2和消耗的O2的物质的量之比一定时
1.生成的CO2的物质的量小于消耗的O2的物质的量的情况
例7. 某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)
A.C2H4 B.C2H5OH C.CH3CHO D.CH3COOH
解析:产生的CO2与耗氧量的体积比为2:3,设该有机物为1mol,则含2mol的C原子,完全燃烧时只能消耗2mol的氧气,剩余的1mol氧气必须由氢原子消耗,所以氢原子为4mol,即该有机物可以是A,从耗氧量相当的原则可知B也正确。答案为A、B。
2.生成的CO2的物质的量等于消耗的O2的物质的量的情况
符合通式Cn·(H2O)m
3.生成的CO2的物质的量小于消耗的O2的物质的量的情况
(1)若CO2和O2体积比为4∶3 ,其通式为(C2O)n ·(H2O)m。
(2)若CO2和O2体积比为2∶1 ,其通式为(CO)n ·(H2O)m。
题型四:有机物完全燃烧时生成的CO2和H2O的物质的量之比一定时
有机物完全燃烧时,若生成的CO2和H2O的物质的量之比为a:b,则该有机物中碳、氢原子的个数比为a:2b,该有机物是否存在氧原子,有几个氧原子,还要结合燃烧时的耗氧量或该物质的摩尔质量等其他条件才能确定。
例8. 某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1:1,由此可以得出的结论是
A.该有机物分子中C:H:O原子个数比为1:2:1
B.分子中C:H原子个数比为1:2
C.有机物必定含O
比较判断耗氧量的方法步聚:①若属于烃类物质,根据分子中碳、氢原子个数越多,耗氧量越多直接比较;若碳、氢原子数都不同且一多一少,则可以按1个碳原子与4个氢原子的耗氧量相当转换成碳或氢原子个数相同后再进行比较即可。②若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为CxHy·(H2O)n或CxHy·(CO2)m或CxHy·(H2O)n·(CO2)m形式,再按①比较CxHy的耗氧量。
2.有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中碳原子或氢原子的个数一定;若混合物总物质的量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的量保持不变,则混合物中各组分中碳或氢原子的个数相同。
例4. 相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是
A.C3H4和C2H6
B.C3H6和C3H8O
C.C3H6O2和C3H8O D.C3H8O和C4H6O2
解析:A中C3H4的耗氧量相当于C2H8,B、C、D中的C3H8O可改写为C3H6·(H2O),C中的C3H6O2可改为C3H2·(H2O)2,D中的C4H6O2可改为C3H6·(CO2),显然答案为B、D。
例5. 1molCxHy(烃)完全燃烧需要5molO2,则X与Y之和可能是
A、X+Y=5
B、X+Y=7 C、X+Y=11 D、X+Y=9
解析:根据烃燃烧通式可知,1molCxHy的耗氧量为 ,讨论易知,当x=3,y=8时合理,答案为C。
例6. 有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数) ( )
A.8n
B.14n
C.18n
D.44n
解析: A中的一个碳原子被B中的四个氢原子代替,A和B的分子量相差8的倍数,即答案A. 如果A和B的分子组成相差若干个H2O或CO2 ,耗氧量也不变,即分别对应答案C和D。
题型三:一定量的有机物完全燃烧,生成的CO2和消耗的O2的物质的量之比一定时
1.生成的CO2的物质的量小于消耗的O2的物质的量的情况
例7. 某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)
A.C2H4 B.C2H5OH C.CH3CHO D.CH3COOH
解析:产生的CO2与耗氧量的体积比为2:3,设该有机物为1mol,则含2mol的C原子,完全燃烧时只能消耗2mol的氧气,剩余的1mol氧气必须由氢原子消耗,所以氢原子为4mol,即该有机物可以是A,从耗氧量相当的原则可知B也正确。答案为A、B。
2.生成的CO2的物质的量等于消耗的O2的物质的量的情况
符合通式Cn·(H2O)m
3.生成的CO2的物质的量小于消耗的O2的物质的量的情况
(1)若CO2和O2体积比为4∶3 ,其通式为(C2O)n ·(H2O)m。
(2)若CO2和O2体积比为2∶1 ,其通式为(CO)n ·(H2O)m。
题型四:有机物完全燃烧时生成的CO2和H2O的物质的量之比一定时
有机物完全燃烧时,若生成的CO2和H2O的物质的量之比为a:b,则该有机物中碳、氢原子的个数比为a:2b,该有机物是否存在氧原子,有几个氧原子,还要结合燃烧时的耗氧量或该物质的摩尔质量等其他条件才能确定。
例8. 某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1:1,由此可以得出的结论是
A.该有机物分子中C:H:O原子个数比为1:2:1
B.分子中C:H原子个数比为1:2
C.有机物必定含O
D.无法判断有机物是否含O 答案:B、D 题型五:有机物完全燃烧前后气体体积的变化 1.气态烃(CxHy)在100℃及其以上温度完全燃烧时气体体积变化规律与氢原子个数有关 ①若y=4,燃烧前后体积不变,△V=0 ②若y>4,燃烧前后体积增大,△V>0 ③若y<4,燃烧前后体积减少,△V<0 2.气态烃(CxHy)完全燃烧后恢复到常温常压时气体体积的变化直接用烃类物质燃烧的通式通过差量法确定即可。 例9. 120℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度,压强体积不变,该烃分子式中所含的碳原子数不可能是 (A)1 (B)2 (C)3 (D)4 解析:要使反应前后压强体积不变,只要氢原子个数可以等于4并保证能使1体积该烃能在4体积氧气里完全燃烧即可。答案:D 例10. 两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中不符合此条件的是 (A)CH4 C2H4 (B)CH4 C3H6 (C)C2H4 C3H4 (D)C2H2 C3H6 答案:B、D 3.液态有机物(大多数烃的衍生物及碳原子数大于4的烃)的燃烧,如果燃烧后水为液态,则燃烧前后气体体积的变化为:氢原子的耗氧量减去有机物本身提供的氧原子数的 。 例11. 取3.40ɡ只含羟基、不含其他官能团的液态饱和多元醇,置于5.00L的氧气中,经点燃,醇完全燃烧.反应后气体体积减少0.560L ,将气体经CaO吸收,体积又减少2.8L(所有体积均在标况下测定)。则:3.4ɡ醇中C、H、O的物质的量分别为:C____; H______; O_______;该醇中C、H、O的原子个数之比为___________。 解析:设3.40ɡ醇中含H、O原子的物质的量分别为x和y 则: x+16y=3.40ɡ-2.80L/22.4L·mol-1×12ɡ·mol-1 …………方程① x/4 –y/2 =0.560L/22.4L·mol-1 …………方程② ⑴、⑵联解可得:x=0.300mol y=0.100mol 进而求得原子个数比。 答案:C. 0.125 mol、H. 0.300 mol、O.0.100 mol; 该醇中C、H、O的原子个数之比为 5∶12∶4
例11.根据烷、烯、炔烃燃烧的反应式,有人总结出以下规律:对于烷烃有n(烷烃)=n(H2O)-n(CO2),对于烯烃有n(H2O)-n(CO2)=0,对于炔烃有n(炔烃)=n(CO2)-n(H2O)。请回答下列问题:
(1)某混合气体由C2H6和C3H4组成。将1.0体积混合气在氧气中充分燃烧,产生的CO2体积比水蒸气多0.2体积(相同状况下测定),通过计算确定C2H6和C3H4的体积。(设体积单位为升)
(2)某混合气由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0体积混合气在氧气中充分燃烧,产生3.0体积CO2和2.4体积水蒸气(相同状况下测定)。
①判断混合气体有________________两类烃组成。
②上述判断的理由是_____________________________________________
(用简要文字叙述)。
③上述两类烃的体积比为_________。
解析:(1)设混合气体中C2H6和C3H4的体积分别为aL和bL,由两个反应式可得出下列关系:
C2H6+3.5O2→2CO2+3H2O; C3H4+4O2→3CO2+2H2O;
a 2a 3a b 3b 2b

 a + b = 1.0 L
a=0.4L
a + b = 1.0 L
a=0.4L
(2a+3b)-(3a+2b)=0.2L b=0.6L
答:混合气体中含C2H60.4L、C3H40.6L。
(2)①炔烃、烯烃; ②因为V(H2O) <V(CO2),即n(H2O) <n(CO2),肯定有炔烃,又由题意知,另一种为烯烃,故为炔和烯两类烃。 ③V炔︰V烯=6︰4。
3.替元法 例如:C6H4Cl2有3种,C6H2Cl4有3种(将H替代Cl);
2.基元法 例如:丁基有4种,丁醇、丁醛都有4种;
1.记忆法 记住已掌握的常见的异构体数。例如:
(1)凡只含一个碳原子的分子均无异构,甲烷、乙烷、 新戊烷(看作CH4的四甲基取代物)、2,2,3,3-四甲基丁烷(看作乙烷的六甲基取代物)、苯、 环己烷、 乙炔、 乙烯等分子一卤代物只有一种;
(2)丁烷、丁炔、丙基、丙醇有2种;
(3)戊烷、丁烯、戊炔有3种;
(4)丁基C8H10有4种;
(5)己烷、C7H8O(含苯环)有5种;
(6)戊基、C9H12有8种;
2.
 按照碳链异构 位置异构 官能团异构的顺序书写,也可按
按照碳链异构 位置异构 官能团异构的顺序书写,也可按

 照官能团异构 碳链异构 位置异构的顺序书写,不管按照那种方法书写都必须防止漏写和从写
照官能团异构 碳链异构 位置异构的顺序书写,不管按照那种方法书写都必须防止漏写和从写
1.主链由长到短,支链由大到小,位置由心到边,排列由对到邻到
间
31.(20分)填空回答:
(1)已知番茄的抗病与感病、红果与黄果、多室与少室这三对相对性状各受一对等位基因的控制,抗病性用A、a表示,果色用B、b表示、室数用D、d表示。
为了确定每对性状的显、隐性,以及它们的遗传是否符合自由组合定律,现选用表现型为感病红果多室和____________两个纯合亲本进行杂交,如果F1表现抗病红果少室,则可确定每对性状的显、隐性,并可确定以上两个亲本的基因型为___________和___________。将F1自交得到F2,如果F2的表现型有_______种,且它们的比例为_______ _____,则这三对性状的遗传符合自由组合规律。
(2)若采用植物组织培养技术,从上述F1番茄叶片取材制备人工种子、繁殖种苗,其过程可简述为如下5个步骤:

上述过程中去分化发生在第________步骤,再分化发生在第_______步骤,从叶组织块到种苗形成的过程说明番茄叶片细胞具有__________________________。
30、(22分)
回答下列I、II小题:
I、右图表示光照强度对A、B两种C3植物光合作用强度的影响。据图回答:
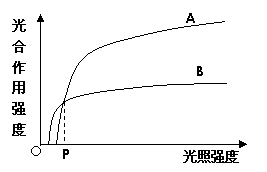 (1)A、B两种植物光合作用过程中对光能利用的
(1)A、B两种植物光合作用过程中对光能利用的
差异是________________________
__
_ 。
(2)在农业生产中,与B植物相比,
A植物应种植在______________条件下。
II、某同学做了如下实验:取A、B两
支试管,在A管中加入煮熟的蚕豆子叶,
B管中加入发芽的蚕豆子叶。在两管中分
别加入甲烯蓝溶液(注:甲烯蓝氧化态为蓝色,接受氢后为无色)一段时间后倒出溶液,两管中的子叶都呈蓝色。然后,两管分别加水淹没子叶、抽气,在水面上覆盖适量石蜡油,37℃保温一段时间后,发现A管中的子叶不变色,B管中的子叶蓝色变浅。取出子叶放在滤纸上,一段时间后,发现A管中取出的子叶不变色,B管中取出的子叶蓝色变深。
根据上述实验现象,回答问题:
(1)37℃保温一段时间后,B管子叶蓝色变浅的原因是_________________.
(2)滤纸上B管子叶蓝色变深的原因是______________________________
(3)A管子叶37℃保温后不变色的原因是___________________________。
(4)该实验设置A管的目的是__________________________。
29、我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。
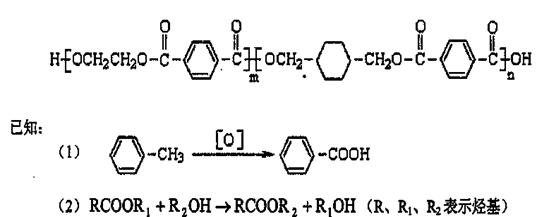
这种材料可采和以下合成路线:
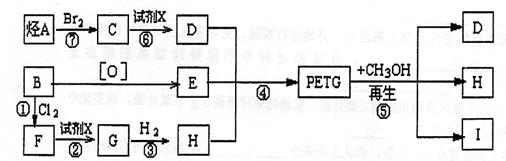
试回答下列问题:
(1)反应②⑥加入的试剂X是 ,⑤的反应类型是 。
(2)写出结构简式:B ,I 。
(3)合成时应控制的单体的物质的量
n(D):n(E):n(H)= : : (用m、n表示)。
(4)写出化学方程式:
反应③: ;
反应⑥: 。
28、某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,设计了如图所示的装置。已知,三氧化硫遇水生成硫酸并放出大量热,容易形成酸雾。试回答:
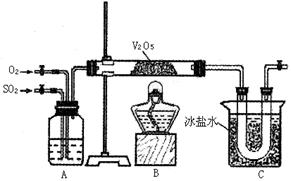
(1)A装置可用来观察二氧化硫和氧气的进气量。实验时应使A中氧气导气管冒出气泡与二氧化硫冒出气泡的速率相近。其目的是 ,A中的药品是 ;
(2)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是 。在实验过程中不能持续加热的理由是 ;
 (3)若用ag铜跟足量浓硫酸反应制二氧化硫,实验结束时得到bg三氧化硫,该实验中二氧化硫的转化率不小于
。
(3)若用ag铜跟足量浓硫酸反应制二氧化硫,实验结束时得到bg三氧化硫,该实验中二氧化硫的转化率不小于
。
(4)老师说该实验装置设计不完整,你认为还缺少 装置,请你协助该研究小组设计出所缺装置 (用简要文字回答)。
(5)标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是 。
A.H2S SO2 B.O2 C.H2S D.SO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com