
3.某蛋白质由m条肽链、n个氨基酸组成。该蛋白质至少有氧原子的个数是 ( )
A. n-m B. n-2m C. n+m D. n+2m
2.最能体现同一生物不同细胞功能差异的是 ( )
A.细胞核的大小和数量 B.细胞膜上载体的种类和数量
C.细胞器的种类和数量 D.细胞的大小和形状
1.下列关于真核细胞结构和功能叙述中,错误的是 ( )
A. 抑制线粒体的功能会影响主动运输
B. 核糖体由RNA和蛋白质构成
C. 有分泌功能的细胞才有高尔基体
D. 溶酶体可消化细胞器碎片
19.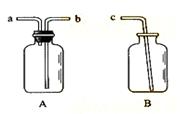 (Ⅰ) 用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
(Ⅰ) 用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
。
解析:收集NO不能用排空气法,只能用排水法。由题给的装置来看,A装置用来收集气体,并且气体应a进b出,B装置用来盛装排出的水。
答案:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中。
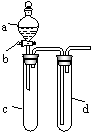 (Ⅱ)(2007·重庆高考,27)(16分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(Ⅱ)(2007·重庆高考,27)(16分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是______________ _。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是 ______________________________。再由a向c中加2 mL蒸馏水,c中的实验现象是__________ _____________
_____________
 。
。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_______,理由是____________________________ 。
|
方案 |
反应物 |
|
甲 |
Cu、浓HNO3 |
|
乙 |
Cu、稀HNO3 |
|
丙 |
Cu、O2、稀HNO3[来源:] |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为__________________________________,实验现象为____________________________;但此实验的不足之处是___________________________。
解析:(1)由题目信息来看,这个操作在实验前,又形成密闭体系,很明显是进行气密性
18. 下列离子方程式书写正确的是( )
下列离子方程式书写正确的是( )
A. 在稀氨水中通入过量CO2: 2NH3·H2O+CO2=H2O+2NH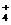 +CO32-
+CO32-
B.NH4HSO3溶液与足量的NaOH溶液混合加热:
NH4++HSO3-+2OH- NH3Ÿ+SO32-+2H2O
NH3Ÿ+SO32-+2H2O
C. 用稀HNO3溶解FeS固体: FeS+2H+=Fe2++H2S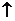
D.AgNO3溶液中加入过量的氨水: Ag++N H3·H2O=AgOH +NH4+
H3·H2O=AgOH +NH4+
解析:在稀氨水中通入过量CO2应生成HCO3-而不是CO32-,故A选项错误;B项电荷和原子守恒,符合反应实际,正确;稀HNO3有强氧化性,可把H2S与Fe2+氧化,应为FeS+4HNO3=Fe(NO3)3+S↓+NO+H2O(还有可能生成SO2或SO3), C错;AgOH溶于过量氨水,所以D错。
答案:B
17.已知25%氨水的密度为O.91g/cm3,5%氨水的密度为0.98g/cm3 ,若将上述两溶液等体积混合, 所得氨水溶液的质量分数是( )
所得氨水溶液的质量分数是( )
 A.等于15% B.大于15% C.小于15% D.无法估算
A.等于15% B.大于15% C.小于15% D.无法估算
16. 将aL NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为bL(气体体积均在同温同压下测定),该bL气体中的NH3体积分数是( )
A. B.
B.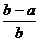 C.
C.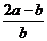 D.
D.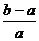
解析:由2NH3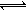 N2
+ 3H2
N2
+ 3H2 可知有多少氨气参加反应总体积就会增加多少,参加反应的氨气为b-a,未反应的氨气为a-(b-a)=2a-b,该bL气体中的NH3体积分数是
可知有多少氨气参加反应总体积就会增加多少,参加反应的氨气为b-a,未反应的氨气为a-(b-a)=2a-b,该bL气体中的NH3体积分数是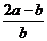 。
。
答案:C
15. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L
NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L
NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
解析:1.68LO2的物质的量为0.075mol,这些O2氧化NO、N2O4、NO2的混合气体得到电子的物质的量与铜和浓硝酸反应时失去电子的物质的量相等。则有2n(Cu)=0.075mol×4,得n(Cu)=0.15mol,则Cu2+的物质的量也是0.15mol,使这些Cu2+完全沉淀所需NaOH0.3mol,体积为60mL。
答案:A
14. 将某合金(仅含铜、铁)全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物),下列说法正确的是( )
将某合金(仅含铜、铁)全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物),下列说法正确的是( )
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若硝酸有剩余,溶液中可能含有Fe2+
D若金属全部溶解,且产生336 mL气体(标准状况),则b = 0. 3
13. 研究发现,空气其中少量的NO2能参与硫酸型酸雨的 形成,反应过程如下:
形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.蓝矾在浓硫酸中由蓝色变为白色
C.浓H2SO4滴入氯化钠固体中,加热
D.加入少量H2SO4使乙酸乙酯水解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com