
(三)免疫活性物质:浆细胞分泌的抗体、效应T细胞分泌的淋巴因子以及溶菌酶等。
(二)免疫细胞:是指发挥免疫作用的细胞,主要有吞噬细胞和淋巴细胞,其中后者又可分为B细胞和T细胞
(一)免疫器官:免疫细胞生成、成熟或集中分布的场所。如骨髓、胸腺、淋巴结等。
31.(16分)I.2007年12月16日《北京晨报》报道,上海诞生世界首例携绿色荧光蛋白基因的转基因克隆兔,为研究某些疑难杂症奠定了基础。专家介绍,从外表看去,克隆兔并没什么与众不同的地方,但通过设备检测会发现它的体内可发出明亮的绿色荧光。由于兔子克隆胚胎发育率低、出生后死亡率高,导致了科学家较难培育出转基因克隆兔
下面是我国胎兔(妊娠20天左右的兔胚胎)背部皮肤成纤维细胞克隆试验的基本过程:
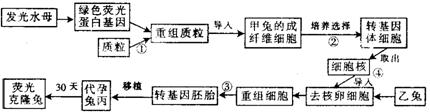
(1)为便于在①过程中与绿色荧光蛋白基因连接,质粒应该具有的一个明显特点是
(2)在②过程进行转基因体细胞的筛选时,采取的选择措施是
(3)对于上述过程叙述合理的是 。
A.该培养过程采用了转基因技术、核移植技术、动物细胞培养技术、胚胎移植技术等
B.通过③过程进行重组细胞培养的结果说明,高度分化的动物细胞仍然具有全能性
C.甲兔实际为妊娠20天的兔胚胎,原因是此时的细胞还没有分化,分裂能力很强
D.该荧光兔的性别应该与乙兔相同
II.现有某XY型性别决定的多年生观赏植物,发现其抗除草剂对不抗除草剂为显性,由常染色体上的A 和a基因控制;花瓣单色对彩色为显性,由X染色体上的B和b基因控制;另有耐盐基因位于线粒体DNA上。
①、验证花色和耐盐基因所在的位置,常用的遗传实验方法是
__________________。
②、现有以下纯种植株若干:
甲:不抗除草剂彩色耐盐雄株 丙:抗除草剂单色不耐盐雌株
乙:不抗除草剂彩色不耐盐雄株 丁:抗除草剂单色耐盐雌株
请利用上述四种植株(甲-丁),通过杂交育种培育抗除草剂、彩色、耐盐的雌雄植株:
第一年:可用作亲本的杂交组合是________________________;
第二年:从子一代植株中选取表现型为_______________________________的植株和甲-丁中的___________杂交;
第三年:从子二代植株中选出抗除草剂彩色耐盐的雌雄植株。其中选出的雄株核基因的基因型为__________________。
30.(26分)I. 下图1和图2分别表示甘蔗和大豆的光合速率与CO2浓度的关系,甘蔗和人参的CO2吸收量与光照强度的关系。请据图回答问题:
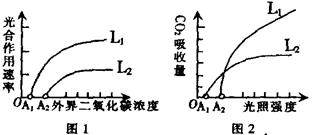
(1)图1中的曲线L1表示的植物是 ,图2中L2表示的植物是 。(填植物名称)
(2)甘蔗和大豆的叶片解剖结构最大的区别是甘蔗 。
(3)夏季,将一植株放在密闭玻璃罩内,置于室外一昼夜,获得实验结果如下图所示。请回答下列问题:
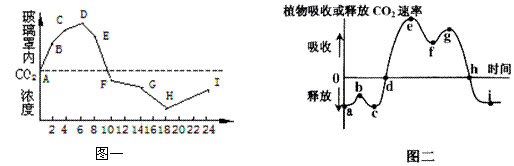
图二中的b点对应于图一中的________点, 图二中的ef段的C3的含量___________(填“增多”或“减少”),到达图二中__________点时,植物体积累的有机物最多。经过这一昼夜之后,植物体的有机物含量会___________。(填“增加”、“减少”或“不变”)
II. 某同学通过以下实验探究光合作用速率与CO2浓度的关系:用打孔器从菠菜植株的叶片打取直径1cm的小圆片40片,用针筒抽去叶圆片叶肉细胞间隙的气体后,随机均分4组并分别放入A、B、C、D四个各装有60ml蒸馏水的锥形瓶中,叶圆片全都沉入水底,随后按下表操作,并记录实验结果。 (蒸馏水中的溶解氧忽略不计)
|
编号 |
加入NaHCO3(g) |
与200W灯泡的距离(m) |
30min后叶圆片上浮数 |
|
A |
0 |
0.5 |
0 |
|
B |
1 |
0.5 |
2 |
|
C |
3 |
0.5 |
5 |
|
D |
5 |
0.5 |
6 |
(1)分析表中实验数据可得出的实验结论是______________________________
(2)B、C、D三个锥形瓶中未上浮的叶圆片能否进行有氧呼吸?_______________。理由是______________________________________________________。
(3)另一同学重复上述实验时,将D锥形瓶与200W灯泡的距离设置过远,其它操作不变, 30min后发现无叶圆片上浮。其原因是______________ __。
(4)若要探究光合作用速率与光照强度的关系,需对上述实验方案作出适当的调整。请补充完整调整思路:
① 往A、B、C、D四个锥形瓶中加入的NaHCO3 应 。
② A、B、C、D四个锥形瓶与200W灯泡的距离应 。
29、为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将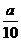 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和 ;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是
;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
28、(12分)
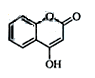
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
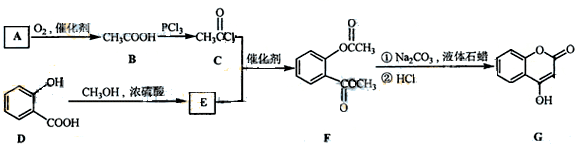
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构简式是
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
(5)下列关于G的说法正确的是( )
a.能与溴单质反应 b. 能与金属钠反应
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
27.(15分) A、B、C、D、E、F、G是中学常见的化学物质。反应关系如下图,反应①②③是工业上生产E的反应原理,其中发生反应③的设备叫吸收塔。A是一种重要的矿石,G是一种红褐色的沉淀。回答以下问题:

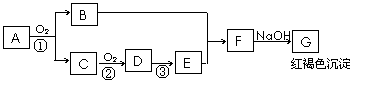
(1)写出化学式:A_______________; E______________; G_______________。
(2)写出反应①的化学反应方程式:____________________________________,并指出工业上发生反应①的设备名称__________________。
(3)请写出F溶液中与C发生反应的离子反应方程式:
_______________________________________________________________。
(4)将F溶液滴加的沸水中,形成一种红棕色透明液体,其“溶质”颗粒大小为4nm。请写出此过程的反应离子方程式____________________________________;欲使此澄清透明的液体最终产生聚沉现象可采用__________(填字母代号)。
A.加热 B.加入足量的硫酸
C.加入硅酸胶体 D.加入氢氧化铝胶体
(5)若在生产过程中①步的损耗为20%,第②步的转化率为95%,第③步无损耗,则生产质量分数为98%的E 100吨,需要的A矿石的质量为_________________________(保留三位有效数字)。
26、下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
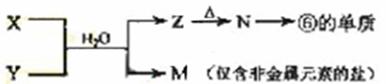
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
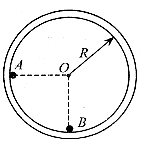
25.(20分)某个星球的半径与地球半径相等,质量是地球质量的4倍。在该星球表面有如图所示的半径为R的光滑圆形轨道固定在竖直面内,质量为m的小球A,以竖直向下的速度v从与圆心等高处开始沿轨道向下运动,与静止于轨道最低点的B球相撞,碰撞后A、B球恰能分别到达左右两边与圆心等高处。已知地球表面的重力加速度为g。试求:
(1)小球召的质量M=?
(2)第一次碰撞刚结束时小球A对轨道的压力大小?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com