
11.(9分)
(1)K = (1分), 不能(1分)
(2) 0.63 (2分) 是(1分)
(3) 0.003(1分),反应物浓度下降(1分)。
(4)适当升高温度(54~78.5℃之间)将甲酸乙酯蒸出。(2分)
16.(10分)已知某一温度下:H2(g)+CO2(g) 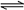 CO(g)+H2O(g), K=1;现往1.0L的密闭容器中投入1.0molH2以及2.0molCO2。
CO(g)+H2O(g), K=1;现往1.0L的密闭容器中投入1.0molH2以及2.0molCO2。
(1)求反应达到平衡后两物质的转化率分别为多少?
(2)若保持相同的条件,改为投入1.0molH2以及4.0molCO2,求反应达到平衡后两物质的转化率又分别为多少?
(3)通过上面的计算,若在化工生产中得到启示是:___________________________
__________________________________________________________________。
2009高三化学专题训练(17)(化学平衡常数)
15.(12分)恒温下,将a
mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)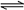 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻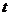 时,nt =(N2)=13 mol, nt
(NH3)=6 mol,计算a的值 。
时,nt =(N2)=13 mol, nt
(NH3)=6 mol,计算a的值 。
(2)反应达平衡时,混合气体的体积为716.8L(状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量 。
(3)原混合气体与平衡混合气体的总物质的量之比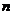 (始):
(始): (平)=_____________。(写出最简整数比,下同),
(平)=_____________。(写出最简整数比,下同),
(4)原混合气体中,a∶b= 。
(5)达到平衡时,N2和H2的转化率之比, (N2)∶
(N2)∶ (H2)=
。
(H2)=
。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)= 。
14.(12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应
2SO2(g)+O2(g)  2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。计算该条件下反
应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
(A)升高温度 (B)降低温度 (C)增大压强
(D)减小压强 (E)加入催化剂 (G)移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为_________________________________________________________________。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是________________________________________。
13.(8分)下列反应在210℃时达到平衡:
①PCl5(g) PCl3(g)+Cl2(g); △H1>0 K1=1mol·L-1
PCl3(g)+Cl2(g); △H1>0 K1=1mol·L-1
②CO(g)+Cl2(g) COCl2(g);△H1<0 K2=5×104L·mol-1
COCl2(g);△H1<0 K2=5×104L·mol-1
③COCl2(g) CO(g)+Cl2(g)
CO(g)+Cl2(g)
(1)反应③的平衡常数K3 = 。
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号)。
A.降低反应①、②体系中Cl2浓度 B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度 D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
12.(9分)氨是重要的化工原料。某工厂以天然气、水蒸气和空气为原料合成氨的流程如下:
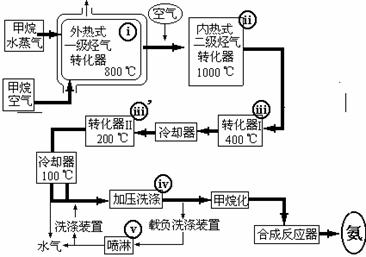
上述流程中外热式一级烃转化器:系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置。内热式二级烃气转化器:系指以H2在装置内燃烧为能量维护一级烃气转化器所生成的CO与H2O(气)反应生成CO2和H2所需1000℃高温的装置。在编号为i-v的反应器中发生如下反应:
(a)CH4+2O2 → CO2+2H2O (b)CH4+H2O(g) → CO+3H2
(c)2CH4+3H2O(g) → CO+CO2+7H2 (d)K2CO3+CO2+H2O → 2KHCO3
(e)CO+H2O CO2+H2 ;ΔH<0 (f)2H2+O2
→ 2H2O
CO2+H2 ;ΔH<0 (f)2H2+O2
→ 2H2O
(1)写出e反应的平衡常数表达式K= ,若只增加H2O的浓度,该反应的正反应速率 ,平衡常数 (填“增大”、“减小”、“不变”)。
(2)反应(f)发生在编号为 的反应器中,它的作用是 。
(3)属于制备合成氨原料气的反应有(填反应方程式编号) ,反应(d)的作用是 。
(4)为什么转化反应要分两步--第一步在400℃时进行,第二步在200℃时进行?
。
11. (9分)实验室制取甲酸乙酯的反应为:HCOOH+CH3CH2OH HCOOCH2CH3
+ H2O
(9分)实验室制取甲酸乙酯的反应为:HCOOH+CH3CH2OH HCOOCH2CH3
+ H2O
反应在该条件下进行时各物质的浓度(mol/L)随时间的变化如下表:
|
时间(min) |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
|
0 |
0.3 |
0.7 |
0 |
0.3 |
|
10 |
0.23 |
a |
b |
c |
|
20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3K Pa时沸点如下:
|
|
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
|
沸点(℃) |
101 |
78.5 |
54 |
100 |
(1)写出该反应的平衡常数表达式K=_______________________。能否由题给条件判断K值随温度变化是增大还是减小___________(选填“能”或“不能”)。
(2)表中,a = ____ mol/L。50℃时,K=1/3,在20min时,反应是否达到平衡______。
(3)在10~20min时,用乙醇表示的平均反应速率为_______________mol/L-1·min-1。该反应速率比0~10min的平均反应速率小,其原因是________________________。
(4)在起始浓度相同的情况下,要提高甲酸乙酯的产率,可采取的具体措施是
___________________________________________________________________。
10.关节炎病因是在关节滑液中形成尿酸钠晶体:
Hur+H2O Ur-+H3O+
① Ur-(aq)+Na+(aq)
Ur-+H3O+
① Ur-(aq)+Na+(aq) NaUr(s)②
NaUr(s)②
尿酸 尿酸根离子
第一次关节炎发作大都在寒冷季节,病灶的部位多为脚趾和手指的关节处,对反应①②的叙述,正确的是
A.①的正反应是吸热反应 B.温度降低,①②两个平衡不会发生移动
C.②的正反应是放热反应 D.以上全不对
9.将1molCO和1molH2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g) CO2+H2,此时有2/3的CO转化为CO2。若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,达到平衡时,混合物中CO2的体积分数可能是下列各值中的
CO2+H2,此时有2/3的CO转化为CO2。若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,达到平衡时,混合物中CO2的体积分数可能是下列各值中的
A.22.3% B.28.2% C.33.3% D.36.8%
8.1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生反应:X(g) + a Y(g) bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A.a=l ,b=l B.a=2 ,b=1 C.a=2 ,b=2 D.a=3 ,b=2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com