
实验题能很好的考查学生分析解决问题能力、创新探究能力、语言文字表达能力,是高考考查的重要能力之一,在选择题中经常结合教材重点实验考查学生的实验分析能力。在简答题中也会结合教材重点实验考查学生实验设计和实验分析的能力。在近几年高考中经常出现的教材试验总结如下
新教材实验区必修本的实验在高考大纲中一共列出了以下19个:
《分子与细胞》
(1)观察DNA、RNA在细胞中的分布
(2)检测生物组织中还原糖、脂肪、和蛋白质(09广东卷6)(09江苏卷21)
(3)用显微镜观察多种多样的细胞(09上海卷19)
(4)观察线粒体和叶绿体(2008年广东,生物,5题)(09广东卷5)
(5)通过模拟实验探究膜的透性(2008年江苏,生物,33题)(2008年上海,生物,20题)(09广东卷31)
(6)观察植物细胞的质壁壁分离和复原(09江苏卷30)
(7)探究影响酶活性的因素(2008年广东,生物,37题)
(8)叶绿体色素的提取和分离(2008年江苏,生物,4题)(09福建卷1)
(9)探究酵母菌的呼吸方式(2008年江苏,生物,31题)(09江苏卷11)
(10)观察细胞的有丝分裂(2008年江苏,生物,29题)(2008年上海,生物,25题)(09广东理基42)
(11)模拟探究细胞表面积与体积的关系
《遗传与进化》
(1)观察细胞的减数分裂(09广东卷27)
(2)低温诱导染色体加倍(09广东卷7)
(3)调查常见的人类遗传病
《稳态与环境》
(1)探究植物生长调节剂对扦插枝条生根的作用
(2)模拟尿糖的检测(2008年广东,生物,35题)(2008年,全国,理综1,1题)
(3)探究培养液中酵母菌数量的动态变化(09广东卷15)(09江苏卷19)
(4)土壤中动物类群丰富度的研究(09江苏卷24)
(5)探究水族箱(鱼缸)中群落的演替
21.(11分)
Ⅰ.(1)① ②
③
(2)
(3)
Ⅱ.
20.(16分)
(1)①
②
(2)
(3)①
②
19.(10分)
(1)
(2)
(3) ① ②
18.(9分)
(1)
(2)
(3)
17.(6分)
(1)
(2)
(3)
21.(11分)
Ⅰ.某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制成100mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): ;
②该滴定操作中应选用的指示剂是: ;
③在G操作中如何确定终点? 。
(2)若碱式滴定管用蒸馏水润洗后,未用标准液润洗,将导致滴定结果 (填“偏小”、“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 (计算结果保留小数点后二位)。
Ⅱ.滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更__ __(填“难”、“易”)溶的缘故。
20. (16分)电解原理在化学工业中有广泛的应用。如图
(16分)电解原理在化学工业中有广泛的应用。如图
表示一个电解池,装有电解液a;X、Y是两块电极板,
通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是______ _____,
在X极附近观察到的现象是________ ____。
②Y电极上的电极反应式为_____ ______,
检验该电极反应产物的方法是 。
(2)若X和Y仍均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为______________________________。通过一段时间后,向所得溶液中加入16gCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为_______________。
(3) 如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是_________________________。
②Y电极的材料是____________,电极反应式是_________________________。
(说明:杂质发生的电极反应不必写出)
19.(10分)
(1) (4分)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_______________;K值大小与温度的关系是:温度升高,K值________________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
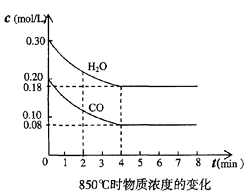 (2)(5分)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应: CO(g)十H2O(g)
(2)(5分)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应: CO(g)十H2O(g)
 CO2(g)十H2 (g) △H<0
CO2(g)十H2 (g) △H<0
CO和H2O浓度变化如右图,则 0-4min的平均反应速率v(CO)=_____________,该温度下平衡常数K的数值为_____ ____。
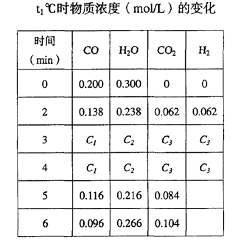 (3) (8分)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
(3) (8分)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
① 表中3min-4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
② 反应在4min-5min间,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com