
16.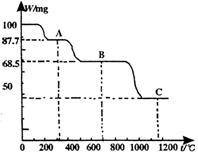 下图是100mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识,回答下列各问题:
下图是100mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识,回答下列各问题:
(1)温度分别为t1和t2时,固体
产物的化学式A是 ,B是
(2)由CaC2O4·H20得到A的化学方程式为
。
(3)由A得到B的化学方程式为
。
(4)由图计算产物C的分子量,并推断C的合理的化学式。
15.在一定条件下,使H2和O2的混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固定体增重2g。求原混合气体中O2和H2的质量。
14.三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:C3N3(OH)3=3HNCO HNCO(异氰酸,其结构是H-N=C=0)能和N02反应生成N2、C02和H20。
(1)写出HNCO和N02反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收1.Okg N02气体所消耗的三聚氰酸的质量。
13.将10.000g氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为9.813g。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为O.721g。求原混合物中各化合物质量。
12.取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混和物的总质量为0.470g,冷却后加入足量水,将反应产物加热蒸干并灼烧,得到氧化镁质量为0.486g。
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式
(2)计算燃烧所得混合物中氮化镁的质量分数
11.已知相对原子质量:Li6.9,Na23,K39,Rb85。今有某碱金属M及氧化物M2O组成的混合物10.8g加足量水反应后溶液经蒸发和干燥得固体16g。据此可确定金属是
A.Li B.Na C.K D.Rb
10.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mLl mol·L-1的盐酸,恰好使混合物完全溶解,放出2.24mL(标况)的气体。所得溶液中,加 入KSCN溶液无血红色出现,那么用足量的CO在高温下还原相同质量的此混合物,得到铁的质量为 ( )
A.2.8g B.5.6g C.11.2g D.无法计算
9.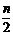
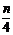
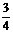 mg铁粉和含ngHNO3,的硝酸溶液恰好完全反应,若m:n=1:3,则起氧化剂作用的HN03的质量为( )
mg铁粉和含ngHNO3,的硝酸溶液恰好完全反应,若m:n=1:3,则起氧化剂作用的HN03的质量为( )
A.mg B. mg C. g D. g
8.工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H20,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH33.50L恰好反应完全,则混合气体中NO和NO2的体积分数比为 ( )
A.1:4 B.1:3 C.1:2 D.1:l
7.向Fe2O3和Fe粉组成的混合物中,加入适量的稀硫酸,各物质恰好完全反应。测得所得溶液中不含Fe3+,且Fe2+与H2的物质的量之比为4:1,那么在反应前Fe2O3、Fe和H2S04之间物质的量之比为 ( )
A.1:l:l B.1:2:3 C.1:2:4 D.2:3:5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com