
20、(10分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
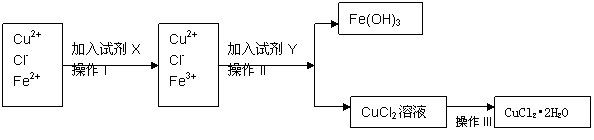
请参照下表给出的数据填空。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Cu2+ Fe2+ Fe3+ |
4.7 7.0 19. |
6..7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A、KMnO4 B、H2O2 C、NaClO D、Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示);
。
19、(10分)实验室利用足量的NH3在加热的条件下与CuO充分反应生成Cu、N2、H2O,并测定Cu的相对原子质量。装置图如下:
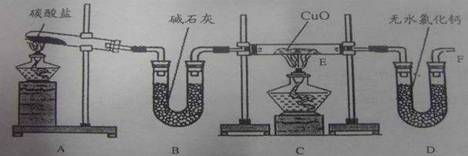
(1)连接好装置后检验装置气密性的方法是
。
(2)用装置A、B制取纯净、干燥的氨气,大试管内碳酸盐的化学式为: ,装置B中碱石灰的作用是: 。
(3)实验中观察到C装置的E管中产生的现象有: ,E管中发生反应的化学方程式为: 。
(4)从实验中测得了下列数据:
①空E管的质量a;
②实验前E管和CuO的总质量b;
③充分反应后E管和Cu粉的总质量c(冷却到室温,干燥后称量);
④充分反应后D管及内盛物质的总质量d
请选择合理的数据列出计算Cu的相对原子质量的计算式(除Cu外,其它涉及到的元素的相对原子质量均为已知);Ar(Cu)== 。
18、(8分)下图表示某典型金属单质A与其化合物之间的转化关系(某些产物和反应条件已略去)。已知:图中所示物质中的组成元素均为短周期元素,化合物C中含有两种金属元素,反应⑤用于工业制取A,反应⑥的产物过滤后得到化合物D的溶液呈碱性。
(1)一步实现图中①至⑥的转化关系中一定属于复分解反应的是(填序); 。
(2)写出一步实现反应④所需加入的化学试剂(填化学式); 。
(3)写出反应①的离子反应方程式: 。
(4)B→C的转化有多种途径,试写出其中两种不同反应类型的化学反应方程式:
;
。
17、(9分)A、B、M、X、Y、Z是周期表中的前20号元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
|
A的最简氢化物 |
B的最简氢化物 |
M的最简氢化物 |
X的氧化物 |
Y的最简氢化物分子构型 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
正四面体 |
对应的水化物为最强酸 |
回答下列问题:
(1)B的最简氢化物的分子构型是: 。
(2)M、X、Z三种元素的简单例子的离子半径由小到大的顺序是(用离子符号和“>”表示) 。
(3)已知M的单质与NaOH溶液反应的产物之一是OM2,试写出该反应的化学方程式:
。
(4)写出B的最简氢化物与Z的氢化物反应后生成物的电子式 。
(5)试比较A和Y的最高价氧化物熔点的高低(用“>”、“ <”或“=”表示); ,并说明理由 。
(6)A元素形成的氢化物有多种,1molA的某种氢化物分子中含有14mole-。已知在25℃,101kPa时1g该氢化物在足量氧气中充分燃烧生成液态水时放出的热量为50kJ,请写出该反应的热化学方程式: 。
16、(8分)请选择“增大”、“减小”、“不变”、“大于”、“小于”或“等于”填空:
(1)升高温度时,水的pH将 。
(2)用水稀释0.1mol/L氨水时,c(OH-)/c(NH3•H2O)的比值将 。
(3)pH相同的盐酸和醋酸,分别用蒸馏水将其稀释到原来的m倍和n倍,稀释后两溶液的pH仍相同,则m n。
(4)将标准状况下的2.24L CO2通入150mL 1mol/L NaOH溶液中,则
c(HCO3-) c(CO32-)。
15、在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的离子浓度为0.2mol/L,当加入等体积0.2mol/LKOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+离子的浓度最接近于
A、0.125mol•L-1 B、0.225mol•L-1 C、0.250mol•L-1 D、0.450mol•L-1
第II卷(非选择题 共55分)
14、有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
|
第一组 |
He -268.8 |
(a)
-249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b)
58.7 |
I2 184.0 |
|
第三组 |
(c)
19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
(d)
42.0 |
H2Te -1.8 |
下列各项判断正确的是
A、abc的化学式分别为Ne2、Br2、HF
B、第三组与第四组相比较,化合物的稳定顺序为:HBr>d
C、第三组物质溶于水后,溶液的酸性:c>HCl>HBr>HI
D、第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键
13、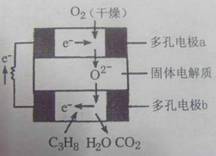 某固体燃料电池以固体氧化铝--氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断不正确的是
某固体燃料电池以固体氧化铝--氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断不正确的是
A、在电池内部氧离子(O2-)向负极移动
B、b极对应的电极反应式为:
C3H8+10O2--20e-===3CO2+4H2O
C、该电池的总反应方程式为:C3H8+5O2===3CO2+4H2O
D、用该电池做点解CuSO4溶液时,每消耗1molC3H8时理论上能得到Cu的最大量为5mol
12、下列判断不正确的是
A、0.1mol/L的NaHA溶液其pH=4,则c(HA-) > c(H+) > c(H2A) > c(A2-)
B、pH=3的盐酸溶液和pH=11的氨水溶液等体积混合后溶液显碱性
C、pH=2的HA溶液与pH=12的MOH溶液任意比例混合后有:
c(H+) + c(M+) === c(OH-) + c(A-)
D、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后有:
c(CH3COO-) + 2c(OH-) === 2c(H+) + c(CH3COOH)
11、将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:
2A(g) + 2B(g) 3C(g) ; △H<0.下列说法不正确的是
A、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲、乙两容器中反映速率均增大
B、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲乙两容器中的平衡均向逆方向移动
C、在相同温度下,甲容器中加入2molA和2molB,乙容器中加入3molC,若甲容器经30s达到平衡状态,则乙容器达到平衡时所需要的时间也是30s
D、在相同的温度和压强下,用甲容器分别进行反应。第一次加入2molA和2molB;第二次加入2molA、2molB和3molC;第三次加入4molC。分别达到化学平衡状态时,C的物质的量百分含量分别为X、Y、Z。则X、Y、Z的大小关系是X=Y=Z。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com