
6.[2008学年第二学期高三周考理综]下表中实验操作能达到实验目的或得出正确结论的是 ( )
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
SO2通入溴水中,溶液褪色 |
检验SO2的漂白性 |
|
B |
向2 mL淀粉溶液中加入稀硫酸,加热2 min,加入新制Cu(OH)2在加热,无明显现象。 |
淀粉在酸性条件下不水解 |
|
C |
将制得的阿司匹林粗产品与饱和碳酸氢钠溶液充分反应后过滤 |
除去阿司匹林中的聚合物 |
|
D |
等体积、pH同为3的酸A和B分别与足量的Zn反应,酸A放出的氢气多 |
酸性A比B强 |
5.下列实验操作都能够达到预期目的的是 ( )
①蒸干AlCl3溶液可得纯净的无水氯化铝学②可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 学③用广泛pH试纸测得某溶液pH为3.5④滴入酚酞溶液确定纯碱中有无烧碱
学③用广泛pH试纸测得某溶液pH为3.5④滴入酚酞溶液确定纯碱中有无烧碱
⑤用米汤直接检验食用盐中是否含有碘元素
 ⑥用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥用酸式滴定管量取20.00mL高锰酸钾酸性溶液
A.①②⑤⑥ B. ②③⑤⑥ C.②⑤⑥ D.全部
4.(2009年宁波效实模拟)将液体Y滴加到盛有固体X的试管中,并在试管口对生成的气体进行检验。下表中固体X、液体Y及检测方法对应关系错误的是 ( )
|
选项 |
固体X |
液体Y |
检测方法 |
|
A |
CaO |
浓氨水 |
蘸有浓盐酸的玻璃棒 |
|
B |
Cu |
浓硫酸 |
干燥的红色石蕊试纸 |
|
C |
Na2O2 |
水 |
带火星的木条 |
|
D |
Na2CO3 |
稀硫酸 |
滴有澄清石灰水的玻璃片 |
3.(2009年宁波高考预测题)下列实验操作能实现或成功的是 ( )
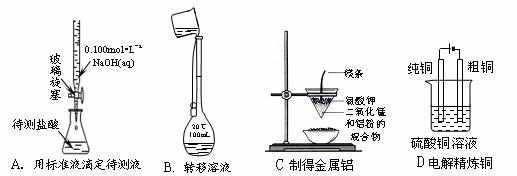
3.(09宁波高三十校联考)关于下列各装置图的叙述中,不正确的是 ( )
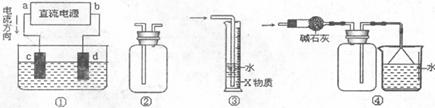
A.装置①中,c为阴极,d为阳极
B.装置②可用于收集H 、NH
、NH 、C1
、C1 、HCl、NO
、HCl、NO 等
等
C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
2.(2009年江宁波高三练习)下列实验操作不正确的是 ( )
A.制摩尔盐时用酒精洗涤产品,而在制阿司匹林时用水洗涤产品
B.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
C.在海带中提取碘的实验中既可以用四氯化碳作萃取剂也可以用酒精作萃取剂
D.如果皮肤上不慎沾有苯酚,应立即用酒精清洗,不可用NaOH溶液冲洗
A.①④⑥
B. ②⑤⑥
C. ②⑥
D. ④⑤⑥ 学
学
1.(2009年浙江虞中学高考冲刺)以下实验方法肯定错误的是 ( )
A.用色谱仪快速检测三聚氰胺的含量
B.用AgNO3检测游泳池水中次氯酸的含量
C.用碘淀粉溶液吸收检测空气中SO2的含量
D. 用纸上层析法分离和检验墨水的成分
10.某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①配制0.100 mol·L-1稀盐酸和0.100mol·L-1NaOH溶液
②取一粒药片(0.100g)研碎后加入20.0ml蒸馏水
③用0.100 mol·L-1NaOH溶液中和,用去体积为Vml
④加入25.0 mL 0.100 mol·L-1稀盐酸。请回答下列问题:
(1)测定过程的正确操作顺序为 (填序号)。
(2)测定过程中发生反应的离子方程式
(3)若某次实验需重复测定四次。实验室现有50ml、100ml、250ml、500ml四种规格的容量瓶,则配制盐酸应选用的容量瓶规格最好为 ,理由是
(4)某同学四次测定的V数据如下:
|
测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
Vml |
15.4 |
12.9 |
13.1 |
13.O |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数。
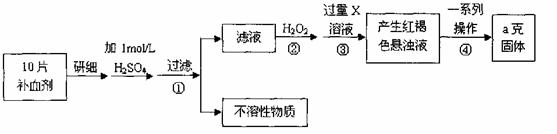 11.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
11.硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含 mgFeSO4·7H2O为片剂。
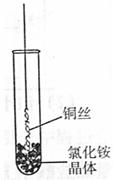 8.(山东省2009届高三检测)Ⅰ.将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒精灯上将该铜丝加热至红热状态。
8.(山东省2009届高三检测)Ⅰ.将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒精灯上将该铜丝加热至红热状态。
如右图所示,趁热插入到试管里的氯化铵晶体中,在试管中
出现白烟。冷却后取出铜丝,可看到铜丝变成光亮的紫红色。
回答下列问题:
(1)解释“当红热的铜丝插入氯化铵晶体中,出现白烟”的原因。
(用化学方程式表示) 。
(2)灼热的氧化铜在氯化铵中变成单质铜,写出该反应的化学
方程式 。
II.2008年,我国的航天事业取得了巨大的成就,航天员翟志刚
顺利实现了太空行走。在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
(1)N2H4·H2O能发生类似NH3·H2O的微弱电离,使溶液显示弱碱性,该电离分两步,写出第一步电离的方程式 。
(2)在实验室中,用水合肼(N2H4·H2O)与NaOH颗粒一起蒸馏,收集114-116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯 B.长直玻璃导管 C.锥形瓶 D.冷凝管
E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是
(3)肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,每生成1molFe3O4,转移电子的物质的量为 ,需要消耗肼的质量为
9.( 2009年浙江高考15分)单晶硅是信息产业中重要的基础材料。通常在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃)四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
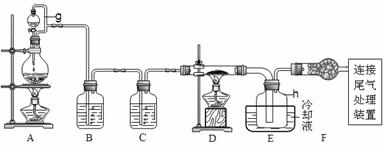
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;装置E中的h 瓶需要冷却的理由是______________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+5===5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?_________(填 “是”或“否”),请说明理由__________。
②某同学称取5.000g残留物后,所处理后在容量中瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________________。
|
7.(09广东化学模拟)下列物质保存方法正确的是( )
①金属钠一煤油或石蜡油; ②过氧化钠一塑料瓶密封;
③水玻璃一橡胶塞细口瓶; ④氯水一毛玻璃塞棕色细口瓶;
⑤苯一毛玻璃塞无色细口瓶; ⑥浓、稀硝酸 毛玻璃塞棕色细口瓶;
A.全部 B.⑤④⑥ C.②④⑥ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com