
1.电离平衡
一定条件下,当分子电离成离子的速率和离子结合成分子的速率相等时,电离过程就达到平衡状态。例:CH3COOH 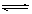 CH3COO-
+ H+
CH3COO-
+ H+
NH3•H2O 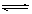 NH4+
+ OH-
NH4+
+ OH-
2.主要板书
2.流程说明
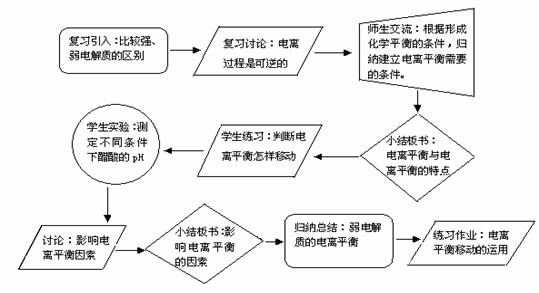
复习引入:比较强、弱电解质的区别。学生填写表格。
复习讨论:醋酸这种具有极性键的共价化合物溶于水时,具有怎样的特点?弱电解质溶于水后不能完全电离的原因是什么?电离过程是可逆的。
师生交流:回忆化学平衡的特征。根据形成化学平衡的条件,归纳建立电离平衡需要什么条件?电离平衡的特点是什么?
小结板书:归纳出电离平衡与电离平衡的特点。得出:(1)弱电解质的电离过程是可逆的。(2)在一定条件下(温度、浓度)v电离 =v结合≠0。(3)一定条件下达到电离平衡状态时,溶液里的离子浓度和分子浓度保持不变,溶液里既有离子存在,也有电解质分子存在。且分子多,离子少。(4)电离平衡是动态平衡,条件改变时,电离平衡可以发生移动。
学生练习:CH3COOH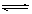 CH3COO-+H+-热。若减小[H+],平衡怎样移动?若增大[CH3COO-],平衡怎样移动?若升温,平衡怎样移动?常温下水的pH为7,为什么升高温度后水的pH为小于7?
CH3COO-+H+-热。若减小[H+],平衡怎样移动?若增大[CH3COO-],平衡怎样移动?若升温,平衡怎样移动?常温下水的pH为7,为什么升高温度后水的pH为小于7?
学生实验:测定不同条件下醋酸的pH(教材P80课堂实验)。
讨论交流:外部条件的改变是怎样的影响电离平衡的?
小结板书:影响电离平衡的因素:温度--电离过程是一个吸热过程,所以,升高温度,平衡向电离方向移动。浓度--电解质溶液浓度越小,平衡向右移动,电离程度增大;电解质溶液浓度越大,平衡向右移动,电离程度减小。
归纳总结:弱电解质的电离平衡。
练习作业:弱电解质溶液中电离平衡移动的运用。
1. 流程图
流程图
药品:0.1mol/L醋酸、水、醋酸钠晶体、pH试纸。
仪器:烧杯、酒精灯、玻璃棒等。
弱电解质的电离平衡,浓度、温度对电离平衡的影响
3.情感态度与价值观
通过对弱电解质电离平衡的学习,体会自然界物质间相互对立统一,彼此依赖的和谐美以及“透过现象看本质”的辩证唯物主义的思想。
1.知识与技能
(1)弱电解质电离平衡(B)
(2)影响电离平衡的因素(B)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com