
2.流程说明
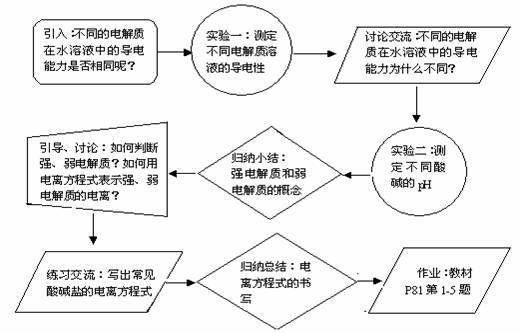
引入新课:不同的电解质在水溶液中的导电能力是否相同呢?探究一:相同条件下,不同的电解质在水溶液中的导电能力。
学生实验一:测定下列电解质溶液的导电性:20 ml 0.1 mol/L的碳酸钠溶液、硫酸镁溶液、氯化钠溶液、盐酸、醋酸、氢氧化钠溶液和氨水。
讨论交流:现象记录与结论:相同浓度、相同体积的不同电解质导电能力不同。学生提问:相同浓度、相同体积的不同电解质,为什么导电能力不同?
学生实验二:测定20 ml 0.1 mol/L的盐酸、醋酸、氢氧化钠溶液和氨水的pH。
引导、讨论:[根据实验数据与P77资料库数据计算c(H+)和c(OH-)] 自由离子的浓度不同,得出结论:自由离子的浓度不同。讨论相同浓度、相同体积的不同电解质,为什么溶液中自由离子的浓度不同?是否所有的电解质都能在水溶液中全部电离成相应的离子呢?
归纳小结:强电解质和弱电解质;强电解质、弱电解质的判断。
练习交流:写出下列酸碱盐的电离方程式。交流如何用电离方程式表示强电解质、弱电解质的电离以及注意事项。
归纳总结:强电解质完全电离,弱电解质可逆电离,多元弱酸分步电离。强电解质电离方程式书写:弱电解质电离方程式书写:
作业:书本P81第1-5题
1.流程图
药品:碳酸钠溶液、硫酸镁溶液、氯化钠溶液、盐酸、醋酸、氢氧化钠溶液和氨水。
仪器:电源、电灯、电极、烧杯、pH计等。
强电解质和弱电解质概念,弱电解质电离方程式的书写。
3.情感态度与价值观
分析强、弱电解质,理解结构和性质的关系。通过强电解质和弱电解质电离方程式的书写,逐步养成严谨的科学态度。
2.过程与方法
通过对相同浓度碳酸钠、硫酸镁、氯化钠溶液导电性比较的实验,及相同浓度盐酸、醋酸、氢氧化钠溶液和氨水的pH测定,学习比较、测定、分析问题的科学思想与学科方法。
1.知识与技能
(1)强电解质、弱电解质(B)
(2)电离方程式(B)
3.影响电离平衡的因素
温度--电离过程是一个吸热过程,所以,升高温度,平衡向电离方向移动。
浓度--电解质溶液浓度越小,平衡向右移动,电离程度增大;电解质溶液浓度越大,平衡向左移动,电离程度减小。
2.电离平衡的特点
①“动”
②“等” v(电离)=v(结合)≠0
③“定” 各微粒浓度不在变化
④“变” 电离平衡是相对的、暂时的、外界条件改变时,平衡就会移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com