
离子反应本质和理解离子反应总是向离子浓度降低的方向进行的规律。
3.情感态度与价值观
通过盐酸与氢氧化钠的中和反应、碳酸根离子检验等实验现象的观察、记录、交流,体验化学的乐趣,感悟科学实验时认真、严谨、求真的重要意义。
2.过程与方法
通过盐酸与氢氧化钠的中和反应、碳酸根离子检验等实验,综合运用物质结构知识、电解质溶液电离等知识,经历分析问题、解决问题,逐步形成分析、比较、归纳的科学研究的方法。
1.知识与技能
(1)离子反应发生的条件、本质及规律(B)
(2)离子方程式意义(B)
教学中采用回忆、实验、讨论、归纳总结的方法组织教学,指导学生运用对比、归纳的方法,根据已学的知识分析强、弱电解质与化合物分类(酸、碱、盐)、化合物类型(离子化合物、共价化合物)和化学键类型的关系,并结合实验事实,依据电解质电离程度的大小得出强电解质和弱电解质的概念,这样从实验事实着手,从化学键的角度分析强、弱电解质与结构的关系,由表及里的分析、归纳,加深学生对强、弱电解质概念概念的内涵和外延的理解,学生也进一步认识结构对物质性质的决定作用,在学习知识的过程中形成学习方法及归纳、总结知识的能力。
建议:有条件的学校,可使用电教手段,借助电脑动画,形象直观地模拟,突破弱电解质的电离及电离方程式书写的难点。
强电解质电离方程式书写:中间用“→”表示完全电离。如:
NaCl → Na+ + Cl-
NaOH → Na+ + OH-
弱电解质电离方程式书写:由于不完全电离,中间用“  ”
可逆符号表示。如: CH3COOH
”
可逆符号表示。如: CH3COOH CH3COO- + H+
CH3COO- + H+
NH3.H20
 NH4+
+ OH-
NH4+
+ OH-
H2CO3  H+ +
HCO3-
H+ +
HCO3-
HCO3-  H+
+ CO32-
H+
+ CO32-
多元弱酸分步电离,分步写电离方程式。
2.弱电解质--在水溶液里只有部分电离为离子
判断:弱酸,如:CH3COOH、H2CO3、HF、HClO
弱碱,如:NH3•H2O
1.强电解质--在水溶液里全部电离为离子的电解质
判断:强酸,如:HCl、HNO3、H2SO4、HBr、HI、HClO4
强碱,如:KOH、NaOH、Ca(OH)2、Ba(OH)2
大部分盐,如:CaCl2、CuSO4、Na2CO3、Mg SO4、BaSO4
2.主要板书
1.教学过程
|
教学内容 |
教师活动 |
学生活动 |
说明 |
|
新课引入 |
[提问]在导电性实验中,我们已经知道,电解质导电是因为它们在水溶液或熔化状态下能产生自由移动的离子。但是,不同的电解质在水溶液中的导电能力是否相同呢? [设计探究活动]探究一:相同条件下,不同的电解质在水溶液中的导电能力。 [实验]测定下列电解质溶液的导电性:20 ml0.1 mol/L的碳酸钠溶液、硫酸镁溶液、氯化钠溶液、盐酸、醋酸、氢氧化钠溶液和氨水。 [实验]测定下列酸、碱的pH:20ml 0.1mol/L的盐酸、醋酸、氢氧化钠和氨水。[根据实验数据与P77资料库数据计算c(H+)和c(OH-)] [提问]相同浓度、相同体积的不同电解质,为什么溶液中自由离子的浓度不同?是否所有的电解质都能在水溶液中全部电离成相应的离子呢? [板书] 三、强电解质和弱电解质 1.强电解质:在水溶液里全部电离为离子的电解质(如:强酸、强碱、大部分盐) 2.弱电解质:在水溶液里只有部分电离为离子。(如:弱酸、弱碱) |
分组实验: 现象记录与结论: 1.灯都亮。 2.灯有明有暗。 导电,导电能力不同。 [疑问]相同浓度、相同体积的不同电解质,为什么导电能力不同? [分组实验]现象记录、计算、结论: 0.1 mol/L盐酸pH,c(H+) 0.1 mol/L醋酸pH,c(H+) 0.1 mol/L氢氧化钠pH,c(OH-): 0.1 mol/L氨水pH,c(OH-) 结论:自由离子的浓度不同。 讨论归纳: 电解质溶液 盐酸 醋酸 氢氧化钠 氨水 电灯 亮 暗 导电性 强 弱 离子浓度 大 小 电离程度 完全 不完全 电解质分类 强电解质 弱电解质 |
提出问题,引起思考。 用实验启发思维,培养观察、记录及分析实验的能力。 |
|
强、弱电解质的判断 |
[提问]如何判断强、弱电解质?强、弱电解质在水溶液中以什么形式存在? [讨论]下列物质在水溶液中的存在形式,并判断哪些是强电解质,哪些是弱电解质。 (1)强酸:HCl、HNO3、H2SO4、HBr、HI、HClO4 (2)强碱:KOH、NaOH、 Ca(OH)2、Ba(OH)2 (3)盐类:CaCl2、CuSO4、Na2CO3、Mg SO4、BaSO4 (4)弱酸:H2CO3、HF、HClO等 (5)弱碱:NH3•H2O等。 [板书]3.强电解质、弱电解质的判断  |
讨论: (1)离子化合物在水溶液中,如氯化钠晶体在水中→Na+、Cl-脱离晶体表面进入溶液→水合钠离子、水合氯离子。离子化合物(溶解)→水合阴离子和水合阳离子 [结果]只有水合离子(完全电离)。 (2)某些极性键的共价化合物在水溶液中,如:HCl气体,分子形式存在,溶于水: 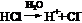 (全部)。 (全部)。 结果:只有水合离子。不存在电解质分子。 结果:只有水合离子。不存在电解质分子。(3)某些极性键的共价化合物在水溶液中,如:CH3COOH  CH3COO- + H+ CH3COO- + H+(部分电离) 结果:既有溶质分子,也有电解质的水合离子。 |
进一步揭示微观过程,由表及里的分析,形成用物质结构知识与结构决定性质的学科思想分析问题的方法,从现象到本质建立强弱电解质的概念。 训练叙述表达能力。 |
|
电离方程式的书写 |
[提问] 如何用电离方程式表示强电解质、弱电解质的电离? [板书并讲解] 四、电离方程式的书写 强电解质:电离方程式,中间用“→”表示完全电离。如:NaCl → Na+ + Cl-,NaOH → Na+ + OH- 弱电解质:电离方程式,由于不完全电离,中间用“  ” 可逆符号表示。如: ” 可逆符号表示。如:CH3COOH  CH3COO- + H+ CH3COO- + H+NH3.H20  NH4+ + OH- NH4+ + OH-H2CO3  H+ + HCO3- H+ + HCO3-HCO3-  H+
+ CO32- H+
+ CO32-多元弱酸分步电离,分步写电离方程式。 电离方程式:强电解质完全电离,弱电解质可逆电离,多元弱酸分步电离。 写出下列酸碱盐的电离方程式: HCl、HNO3、H2SO4、HBr、HI、HClO4 、KOH、NaOH、 Ca(OH)2、Ba(OH)2 CaCl2、CuSO4、Na2CO3、Mg SO4、H2S、HF、HClO、NH3•H2O |
学生练习 |
形成科学的文字表达能力,深化强、弱电解质的概念。 |
|
作业 |
|
书本P81第1-5题。 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com