
2.主要板书
1.教学过程
|
教学内容 |
教师活动 |
学生活动 |
说明 |
|
引入 |
[讲述]通过上一节课的学习,我们已经认识了离子反应,本节课我们学习离子方程式的书写,先请同学们完成下列化学实验: (1)碳酸钙与盐酸反应 (2)碳酸钾溶液与盐酸反应 (3)稀硫酸与氯化钡溶液反应 (4)硫酸钠溶液与氢氧化钡溶液反应 [板书]写出上述反应的化学方程式与离子方程式。 [提问] (1)以上反应属于化学反应基本类型中的哪一类? (2)溶液中发生的复分解反应有那些条件? (3)请同学们根据以上练习,比较离子方程式与化学方程式的区别是什么? (4)请同学们根据以上练习,归纳出书写离子方程式的步骤是什么? |
分组实验: 记录现象: 交流观察到的现象: 讨论: 以上反应都是在溶液中发生的复分解反应,其实质都是离子反应。 溶液中能发生的复分解反应,生成物中要有难溶物、弱电解质、气体。 离子方程式与化学方程式不同,它反映了离子反应的实质,不仅能表示一定物质间的某个反应,而且可以表示同一类型的离子反应。 同时它只表示发生在溶液中的离子反应。用实际参加反应的离子的符号来表示反应。在书写各类离子方程式时,一定要注意哪些物质写成离子形式,哪些物质写成化学式。 书写(1)的离子方程式时碳酸钙不能用离子符号表示,因为它难溶于水,要用化学式表示。书写(3)的离子方程式时H2O不能删去,只要反应物或生成物可以拆为离子形式,即使方程式左右两边没有可删去的离子,也可写为离子方程式。 |
实验引入课题,激发学习兴趣。 训练科学文字表达能力。 分析归纳能力的训练 |
|
离子方程式的书写步骤 |
[板书] 二、离子方程式的书写 1.溶液中发生复分解反应条件 生成: 难溶物,如:CaCO3 、BaSO4等 弱电解质,如:H2O、NH3•H2O等 气体如:CO2、NH3、H2S等 2.离子方程式的书写步骤 例:碳酸钙与盐酸反应 (1)“一写”正确书写化学方程式。 CaCO3+2HCl→CaCl2+CO2↑+H2O (2)“二改”把可溶性强电解质拆写成离子符号,把弱电解质、难溶物、气体、单质和氧化物仍写为分子式或化学式。 CaCO3+2H++2Cl-→Ca2++2Cl-+CO2↑+H2O (3)“三删”删去方程式两边相同的离子。 CaCO3+2H+→Ca2++ CO2↑+H2O (4)“四查”检查离子方程式两边的原子数和电荷数是否守恒。 |
|
|
|
离子方程式书写要领 |
[小结]根据上述讨论、归纳,我们可以总结出离子方程式的书写要领是:只把可溶性强电解质用离子符号表示,其余均用化学式表示。 [提问]那么,可溶性强电解质包括哪些物质? [提问]是否只有溶液中发生的复分解反应才是离子反应? 先请同学们完成下列化学实验: (1)铁与硫酸铜溶液反应 (2)锌与稀硫酸反应 写出上述反应的化学方程式与离子方程式。 [提问](1)以上反应属于化学反应基本类型中的哪一类? (2)书写离子方程式时应注意什么? [训练]写出以下置换反应的离子方程式Fe+CuSO4→Cu + FeSO4 Fe+Cu2+→Cu + Fe2+ Zn+H2SO4→ZnSO4+ H2↑ Zn+2H+→Zn2++ H2↑ |
思考、复习物质的溶解性表: 可溶性强电解质包括强酸、强碱和可溶性盐。 分组实验: 记录现象: 交流观察到的现象: 讨论: 溶液中的置换反应也可以用离子方程式表示。 因为置换反应一定是氧化还原反应,所以书写离子方程式时,还要检查得失电子是否守恒。 写出离子方程式交流: |
实验观察记录能力的训练。 |
|
巩固概念 |
1.写出下列化学反应的离子方程式。 (1)硫化亚铁与盐酸反应; (2)澄清石灰水与稀盐酸反应 (3)氢氧化镁与稀硫酸反应; (4)铜片插入硝酸银溶液中; (5)氯化铵溶液与氢氧化钠溶液共热反应 2.判断下列离子方程式书写是否正确,为什么? (1)二氧化锰和浓盐酸反应:MnO2+4H++2Cl- 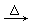 Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O(2)亚硫酸钠与稀硫酸反应: SO32-+2H+→H2O+SO2↑ (3)硫酸镁溶液跟氢氧化钡溶液反应: SO42-+Ba2+→BaSO4↓ (4)向小苏打溶液中加入醋酸溶液: HCO3- + H+ → CO2↑+ H2O 请同学们根据以上练习,总结书写离子方程式还应注意哪些问题? |
FeS +2 H+→ Fe2++
H2S↑ H++OH- → H2O 2H++Mg(OH)2→ Mg2++2H2O Cu+2Ag+→Cu2++2Ag NH4++OH- 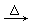 NH3↑+H2O NH3↑+H2O讨论,找出错误的原因。 归纳:判断离子方程式正确与否的方法. (1)查反应能否发生。 (2)查反应物、生成物是否正确。 (3)查各物质拆分是否正确。 (4)查是否符合守恒关系(如:质量守恒和电荷守恒等)。 (5)查是否符合原化学方程式。 |
离子方程式书写正确性的反馈。 训练严谨的思维。 |
|
强调一些问题 |
[提问]书写离子方程式还应注意哪些问题? [归纳]1.微溶物(如:Ca(OH)2、CaSO4等)以澄清或饱和溶液的形式作为反应物时,可拆为离子形式,生成物中微溶物一般不拆为离子形式。 2.固体与固体之间、固体与浓硫酸之间的反应一般不写为离子方程式。 例:实验室制NH3,用固态铵盐与固体Ca(OH)2反应: 2NH4Cl+Ca(OH)2 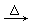 CaCl2+H2O CaCl2+H2O+NH3↑ 离子方程式只能适用于在溶液中进行的离子反应,因此固体与固体间的反应一般不用离子方程式表示。浓硫酸中溶质的质量分数一般为98%,水的含量很少,硫酸基本上是以分子的形式存在,所以在离子方程式中浓硫酸应写成化学式。而浓硝酸中溶质的质量分数一般为69%,浓盐酸中溶质的质量分数一般为36%,其溶液中溶质几乎全部以离子形式存在,所以在离子方程式中浓盐酸、浓硝酸可以写为离子形式。 |
讨论:书写离子方程式还应注意的问题如下: (1)化合物电离出的阴、阳离子的个数比要正确。 (2)微溶物(如:Ca(OH)2、CaSO4等)以澄清或饱和溶液的形式作为反应物时,可拆为离子形式,生成物中微溶物一般不拆为离子形式。 |
|
|
作业 |
判断下列反应能否写为离子方程式,能写的请写出。 (1)硫化亚铁与盐酸反应。 (2)在澄清的石灰水中通入少量的CO2。 (3)在Ca(NO3)2的浓溶液中加入较浓的Na2SO4溶液。 (4)实验室用固体氯化铵与固体熟石灰反应制备氨气。 (5)实验室用固体氯化钠与浓硫酸反应制备氯化氢气体。 |
|
|
2.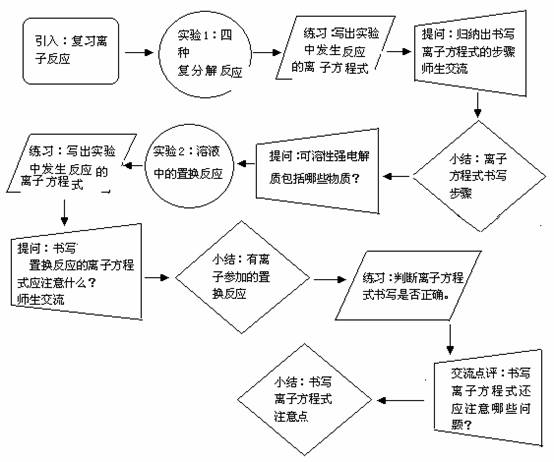 流程说明
流程说明
引入:通过上一节课的学习,我们已经认识了离子反应,本节课我们学习离子方程式的书写。
实验1:学生完成下列化学实验:(1)碳酸钙与盐酸反应;(2)碳酸钾溶液与盐酸反应;(3)稀硫酸与氯化钡溶液反应;(4)硫酸钠溶液与氢氧化钡溶液反应。
练习:写出上述反应的化学方程式与离子方程式。
提问、师生交流:(1)以上反应属于化学反应基本类型中的哪一类?(3)溶液中发生的复分解反应有那些条件?(2)请同学们根据以上练习,比较离子方程式与化学方程式的区别是什么?(3)请同学们根据以上练习,归纳出书写离子方程式的步骤是什么?
归纳小结:1.溶液中发生复分解反应条件;2.离子方程式的书写步骤。
提问交流:根据上述讨论、归纳,我们可以总结出离子方程式的书写要领是:只把可溶性强电解质用离子符号表示,其余均用化学式表示。那么,可溶性强电解质包括哪些物质?是否只有溶液中发生的复分解反应才能发生离子反应?
实验2:溶液中的置换反应:(1)铁与硫酸铜溶液反应;(2)锌与稀硫酸反应。
练习:写出上述反应的化学方程式与离子方程式。
提问交流:(1)以上反应属于化学反应基本类型中的哪一类?(2)书写溶液中的置换反应的离子方程式时应注意什么?
小结:有离子参加的置换反应:因为置换反应一定是氧化还原反应,所以书写离子方程式时,还要检查得失电子是否守恒。
练习:1.写出下列化学反应的离子方程式。2.判断下列离子方程式书写是否正确,为什么?
交流点评:判断离子方程式正确与否的方法:(1)查反应能否发生。(2)查反应物、生成物是否正确。(3)查各物质拆分是否正确。(4)查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)查是否符合原化学方程式。
小结:离子方程式只能适用于在溶液中进行的离子反应,因此固体与固体间的反应一般不用离子方程式表示。
1.流程图
药品:HCl、NaOH、H2SO4、BaCl2、CuSO4、CaCO3、K2CO3、NH4Cl溶液、Fe、Zn。
仪器:试管、滴管
2.难点
离子方程式的书写
1.重点
离子反应发生的条件和离子方程式的书写
3.情感态度与价值观
认识形成对科学概念准确理解的品质和实事求是的科学态度的重要意义。
2.过程与方法
通过离子方程式的书写,形成思维的严密性和表达的条理性与准确性;体验物质转化过程中质量、得失电子、电荷等守恒等定量的学科思想。
1.知识与技能
(1)复分解反应的条件(C)
(2)离子方程式书写(C)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com