
1.知识与技能
(1)饱和氯化钠溶液的电解(B)
(2)电解池的构造与工作原理(B)
本节课的教学设计针对的是一般中学学生的学情。设计的假设依据是:学生已经比较好地掌握了强、弱电解质、水的电离、弱电解质的电离平衡等知识。由此假设出发,认为学生已经掌握了探究的必要知识储备,因此教学设计中安排了比较多的学生活动:学生实验I、II;学生讨论I、II、III等等。如果在教学过程中发现学生的知识储备不够,教师应及时给与提示,变学生活动为师生活动,加强教师的指导作用,同时,也通过在学习盐类的水解过程中运用过去学过的知识而强化对这些知识的掌握。
2、盐类水解的规律:
有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。
1、盐类水解的本质:在溶液中盐电离出的某种离子与水电离出的H+或OH-结合生成弱电解质的反应。
中和
酸 + 碱 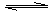 盐 + 水
盐 + 水
水解
弱酸根离子 + H2O 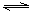 弱酸 + OH-
弱酸 + OH-
弱碱阳离子 + H2O 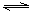 弱碱 + H+
弱碱 + H+
强酸强碱盐 溶液pH=7
强酸弱碱盐 溶液pH<7
强碱弱酸盐 溶液pH>7
7.3盐溶液的酸碱性
2.主要板书
1.教学过程
|
教学内容 |
教师活动 |
学生活动 |
说明 |
|
问题引入 |
酸溶液中H+浓度大于OH-浓度显酸性;碱溶液中OH-浓度大于H+浓度显碱性。盐溶液呈什么性? |
倾听,思考,猜想。 |
|
|
探究实验I |
[组织学生进行实验] [板书] 7.3盐溶液的酸碱性 一、盐溶液的酸碱性 [引导学生得出结论] |
实验:用pH试纸测CH3COONa 、NH4Cl
、NaCl三种盐溶液的pH。 盐溶液不一定显中性。 |
训练学生的化学实验基本操作 |
|
探究实验II |
盐溶液呈现什么性是否存在规律呢? |
思考、猜想 实验:用pH试纸测Na2SO4、Na2CO3 、Al2(SO4)3 、KNO3、FeCl3、Na2S、Cu(NO3)七种盐溶液的pH。并将实验结果填入教材P89“探究与实践”栏目。 |
|
|
总结盐溶液的酸碱性与盐的类型的关系 |
能否根据实验结果,对表中所列出的九种盐进行分类,从而找出盐溶液酸碱性与盐的类型之间的关系? [引导学生小结]] [板书] 强酸强碱盐 溶液pH=7 强酸弱碱盐 溶液pH<7 强碱弱酸盐 溶液pH>7 |
猜想、讨论、交流 得出结论: 可以将盐分成三种类型:强酸强碱盐、强酸弱碱盐、强碱弱酸盐。 盐的类型与盐溶液酸碱性的关系: 强碱弱酸盐的水溶液显碱性,强酸弱碱盐的水溶液显酸性,强酸强碱盐的水溶液显中性。 |
|
|
分析盐类水解的实质 |
盐的组成中既不含H+,也不含OH-,水本身是中性的,为什么加进不同的盐之后就会显酸性、碱性或中性呢? 请以氯化铵为例进行分析。 列出浓度为0.1mol/L的氯化铵溶液中离子浓度大小的顺序。 |
思考 讨论、交流  NH4Cl + H2O 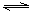 NH3·H2O + HCl NH3·H2O + HCl NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+思考,回答 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
|
|
[板书]二、盐类的水解 1、盐类水解的本质:在溶液中盐电离出的某种离子与水电离出的H+或OH-结合生成弱电解质的反应。 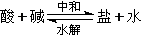 请分析醋酸钠、氯化钠溶液分别呈碱性和中性的原因 列出浓度为0.1mol/L的醋酸钠、氯化钠溶液中离子浓度大小的顺序。 |
讨论、分析 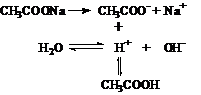 CH3COONa +H2O  CH3COOH + NaOH CH3COO- + H2O 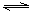 CH3COOH + OH- 氯化钠是强酸、强碱生成的盐,所以其电离产生的离子不能与水电离出来的H+或OH-结合生成弱电解质,因此不水解。 醋酸钠 c(Na+)>c(Ac-)>c(OH-)>c(H+) 氯化钠 c(Cl-)=c(Na+)>c(H+)=c(OH-) |
|
|
|
总结盐类水解的规律 |
[板书] 弱酸根离子 + H2O 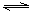 弱酸 + OH- 弱酸 + OH-弱碱阳离子 + H2O 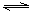 弱碱 + H+ 弱碱 + H+归纳出水解的规律: [板书] 2、盐类水解的规律: 有弱才水解,无弱不水解。 谁弱谁水解,谁强显谁性。 |
思考、讨论、理解。 讨论、分析、倾听、整理、记录。 |
|
|
盐类水解的应用 |
[课堂练习] 1.判断下列盐的溶液的酸碱性。 (1)CH3COOK (2)NH4NO3 2.在配制FeCl3溶液时,直接将FeCl3溶解于蒸馏水中,常见溶液略混浊,请分析原因。如何才能配制出澄清的FeCl3溶液? 3.明矾[KAl(SO4)2·12H2O]可以净水是因为明矾在水中生成Al(OH)3,试分析生成Al(OH)3的原因。将明矾溶液与碳酸钠溶液混合在一起,产生大量CO2,可用于灭火。试分析其中的化学原理。 |
练习,实验验证。 讨论、分析。 |
|
|
|
[作业]:1、看课本。2、本节书后练习。 |
|
|
1.流程图

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com