
2.流程说明
1展示样品:两瓶密闭、体积相等的试剂瓶,分别装有浓硫酸和浓盐酸。
2演示实验:在试管中加入一些胆矾,再加入3-4ml浓硫酸,振荡。
3学生实验:潮湿的纸屑、棉花、木屑中分别滴入几滴浓硫酸。
1.
1.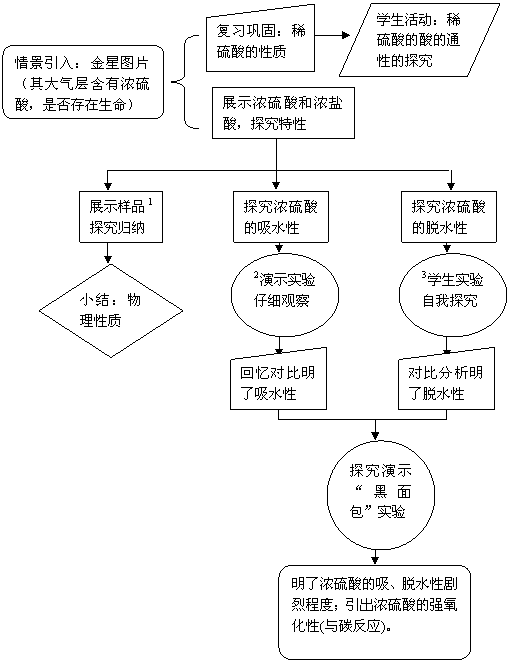 流程图
流程图
浓硫酸、浓盐酸、硫酸铜晶体、水、稀硫酸、纸屑、棉花、木屑、蔗糖、玻璃棒、烧杯、试管、药匙、多媒体。
浓硫酸的吸水性、脱水性。
3.情感、态度价值观
通过浓硫酸和稀硫酸性质的比较学习,感悟“现象与本质”、“量变与质变”等辩证唯物主义的观点;通过浓硫酸的性质实验,加强学生的安全意识和环保意识。
2.过程与方法
通过浓硫酸的性质探究,认识研究物质的方法--结构分析、推测可能的性质、设计实验、观察现象、分析现象、得出结论,再辨证的分析结论的适用范围;学习运用比较、归纳和概括等方法对获取的信息进行加工的能力。
1.知识与技能
(1)稀硫酸的性质(A)
(2)浓硫酸吸水性、脱水性的特性(B)。
2.用新旧知识对比突破难点
为了突破浓硫酸与铜反应的本质这个难点,将浓硫酸与铜反应和稀硫酸与金属反应进行对比分析,从电子得失的角度剖析酸的通性和强氧化性的本质区别,从中得出以下结论,稀硫酸的氧化性实质是氢离子的氧化性,而氢离子的氧化性就是酸的通性之一,但浓硫酸的强氧化性是+6价的硫在特定条件下的氧化性。然后,顺理成章导出浓硫酸的强氧化性的其他表现,这样既突破难点,又调动了学生思维,提高了学生的思维能力。
本节通过设疑引入、演示实验、引导启发、知识对比、归纳总结生等方法的综合运用,较大程度的激发学生的学习积极性,从而促进教学目标的实现。对于本课时重难点的处理,主要采取以下做法:
1.用演示实验法和引导启发相结合,突出重点
新课的中心内容是浓硫酸的强氧化性,而强氧化性主要是通过浓硫酸与铜的演示实验及结果分析得出的,因此,做好这个实验,引导学生仔细观察实验,分析实验现象成为该课的关键之一。为了证明实验中产生的是二氧化硫,而不是氢气,用润湿的品红溶液,学生从品红试纸的褪色现象,很快推出正确结果,由此说明浓硫酸跟金属的反应是较复杂的氧化还原反应。再观察稀释后试管里溶液的颜色,便可推知反应还生成了硫酸铜,这样就可以让学生自己写出这个反应的化学方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com