
本节课首先通过 “金星上有生命存在吗?”的情景设置,告诉学生想要找到答案,就要认真地学习本节的内容。这样学生很快地进入了学习“角色”,想学而乐学,达到了激发学生学习兴趣的目的。然后通过复习提问和讨论,使学生明确稀硫酸具有酸的通性。进而追问“稀H2SO4为什么具有酸的通性”,以强化硫酸是强电解质,在水溶液中能电离生成H+。
关于浓硫酸的物理性质、脱水性和氧化性的教学,主要采用实验、讨论、讲解、归纳相结合的教学方法。首先要做好三个演示实验,给学生以正确、鲜明和深刻的印象。做实验时,要求学生仔细观察,并从分析实验现象入手,认识反应本质。
通过本课时的学习,引导学生认识量变引起质变的规律。同时,在教师的启发下,养成有目的地观察,主动地获取知识,逐步学会分析问题,解决问题的方法。
4、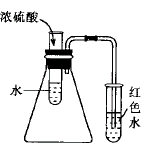 此设计(见右图)利用了浓硫酸稀释放热,使锥形瓶内空气因受热体积膨胀,可观察到试管内导管口有气泡冒出。稍后,温度降低时,导管内有一段液柱。为便于观察可在盛水试管内滴几滴红墨水。由于此实验设计原理与装置气密性的检验原理相同,学生也是易于理解的。
此设计(见右图)利用了浓硫酸稀释放热,使锥形瓶内空气因受热体积膨胀,可观察到试管内导管口有气泡冒出。稍后,温度降低时,导管内有一段液柱。为便于观察可在盛水试管内滴几滴红墨水。由于此实验设计原理与装置气密性的检验原理相同,学生也是易于理解的。
这些实验装置因涉及到多个知识点和相关学科知识,亦可在综合训练和复习时用作能力培训。
(来源:qikan/periodical.Articales/hbzxxsys/hbzx2000/0006000628.htm)
2、 如右图所示。未加入浓硫酸时,小试管内澄清石灰水无变化。当缓慢沿烧杯壁加入浓硫酸并不断搅拌时,可见小试管内澄清石灰水逐渐变浑浊。由于学生在第一章习题中已知碳酸氢铵受热易分解,其产物有二氧化碳,因此由此及彼推断出装置内碳酸氢铵分解所需的热量来自于浓硫酸的稀释。
如右图所示。未加入浓硫酸时,小试管内澄清石灰水无变化。当缓慢沿烧杯壁加入浓硫酸并不断搅拌时,可见小试管内澄清石灰水逐渐变浑浊。由于学生在第一章习题中已知碳酸氢铵受热易分解,其产物有二氧化碳,因此由此及彼推断出装置内碳酸氢铵分解所需的热量来自于浓硫酸的稀释。
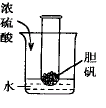 3 如左图所示。由于烧杯内的水起到了凸透镜的放大作用,试管内胆矾晶体清晰可见。沿烧杯壁缓慢加入浓硫酸并搅拌时,通过“凸透镜”。
3 如左图所示。由于烧杯内的水起到了凸透镜的放大作用,试管内胆矾晶体清晰可见。沿烧杯壁缓慢加入浓硫酸并搅拌时,通过“凸透镜”。
可见试管内的部分胆矾因受热而熔化成蓝色的硫酸铜溶液。此实验若通过实物投影仪放大则效果非常好。此实验可用Na2CO3*10H2O代替CuSO4*5H2O,虽熔化效果好一些,但因试管内外均为无色透明液体,因此在教室内学生的视觉观察效果差些。
3.相关链接
“浓硫酸稀释放热”的实验装置设计
初中教材实验对于“浓硫酸稀释放热”是用手去触摸烧杯外壁来感知温度变化的,而在课堂上能触摸感知的学生面是有限的。因此在教学实践中,我们常常用下列装置来显示“浓硫酸稀释放热”的实验效果。
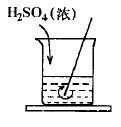 1、用熔化的石蜡将盛水烧杯的底部粘在小木板上,再沿烧杯壁缓缓倒入浓硫酸并不断用玻璃棒搅拌(见右图)。因浓硫酸稀释放热使石蜡又熔化,再拿起烧杯时,则可见烧杯与木板分离。因为石蜡受热熔化是生活常识,因此也培养了学生通过观察现象,分析事物变化本质的思维能力。
1、用熔化的石蜡将盛水烧杯的底部粘在小木板上,再沿烧杯壁缓缓倒入浓硫酸并不断用玻璃棒搅拌(见右图)。因浓硫酸稀释放热使石蜡又熔化,再拿起烧杯时,则可见烧杯与木板分离。因为石蜡受热熔化是生活常识,因此也培养了学生通过观察现象,分析事物变化本质的思维能力。
2、脱水性(炭化)

|
浓H2SO4吸水性与脱水性的比较: |
吸水性 |
脱水性 |
|
对象 |
游离H2O |
有机化合物中的H和O |
|
本质 |
H2SO4+xH2O--H2SO4·xH2O+Q |
按H2O的组成脱去有机物中的H、O原子(2:1),脱去后生成水 |
1、 吸水性(干燥剂)
通常可用浓硫酸干燥的气体有:H2、O2,N2、CO、CO2、CH4、SO2、HCl、C12等:
不能用浓硫酸干燥的气体有:碱性气体:NH3、还原性气体:H2S、HI、HBr等。
纯硫酸是一种无色油状的液体,是一种难挥发的酸。市售硫酸的质量分数有92.5%和98%两种。当浓硫酸吸收了大量的三氧化硫后,就成了发烟硫酸。浓硫酸能以任意比与水混溶,浓硫酸溶解时放出大量的热。
5.3“众酸之王”--硫酸
复习:稀硫酸具有酸的通性。
2.主要板书
1.教学过程
|
教学内容 |
教师活动 |
学生活动 |
说明 |
|
教学引入 |
[投影展示]金星和地球的图片。 [图片说明]金星,又被称为太白金星,是夜晚的天空中最亮的一颗行星;她和地球一样有厚厚的大气层。 [引入]地球的大气主要是由N2、O2组成。只是在近几十年,由于含硫物质的大量燃烧产生酸雨,大气才出现了极少量的硫酸。而在金星的大气层中有一个厚达25公里的浓密云层,它们不是水雾而是由浓硫酸组成,那么硫酸究竟是什么样的一种物质呢?金星上有生命存在吗?学完本节内容,或许我们可以做出初步的推断。 |
仔细倾听,引发好奇心,产生探究兴趣。 |
设置情景,激发学生的求知欲。 |
|
复习稀硫酸的化学性质 |
[板书] 5.3“众酸之王”--硫酸 [复习提问]初中时我们就学习过稀硫酸,回忆稀硫酸具有哪些化学性质?为什么具有这些性质? [提问]酸的通性表现在哪些方面? [投影] 描述下图的实验现象,并说明稀H2SO4的性质。 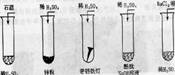 [讲述]请大家完成上述有关反应的离子方程式: [过渡]稀硫酸是一种强酸,具有酸的通性,以H+和SO42-的形式存在,而浓硫酸主要是以H2SO4分子的形式存在,由于溶液中粒子不同,所以性质上肯定有差异,即浓硫酸具有自己的特性。下面我们就一起来探究浓硫酸。 [展示、讨论]展示两瓶密闭、体积相等的试剂瓶,分别装有浓硫酸和浓盐酸,不用化学方法如何加以鉴别? |
思考并回答:稀硫酸具有酸的通性。因为硫酸在水中能电离出H+。 回忆、思考、讨论、回答:与碱中和、与 碱性氧化物生成盐和水、指示剂显色等。 学生先讨论,然后请几名学生描述实验现象,其他同学补充现象。 学生书写方程式(同桌同学互相检查,教师用实物投影检查正误后,投影正确答案) 观察、讨论、学生演示、回答(1)拿起试剂瓶,感觉重的是浓硫酸,因为浓硫酸的密度大。(2)摇动试剂瓶,呈油状、粘稠的是浓硫酸。(3)分别打开瓶盖,瓶口无酸雾的是浓硫酸,因为浓硫酸难挥发。 |
复习稀硫酸的化学性质。 培养学生的观察能力,主动探究,激发学生兴趣。 |
|
学习纯硫酸的物理性质 |
[板书]一、纯硫酸的物理性质: [投影归纳]纯硫酸是一种无色油状的液体,是一种难挥发的酸。市售硫酸的质量分数有92.5%和98%两种。当浓硫酸吸收了大量的三氧化硫后,就成了发烟硫酸。浓硫酸能以任意比与水混溶,浓硫酸溶解时放出大量的热。 [设疑]浓硫酸溶解时放出大量的热,如何稀释浓硫酸呢? [强调]稀释浓硫酸时,若把水倒入浓硫酸中,由于水的密度较小,浮在硫酸的上面,溶解时放出的热不易散失,使水暴沸而骤然气化,结果就像水滴入灼热的油锅一样,带着酸液向四周飞溅,引起伤害事故。 [过渡]因为浓硫酸主要以硫酸分子的形式存在,与稀硫酸的性质是有差异,到底它的差异表现在哪些方面呢? |
回忆、回答: 将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。 |
激活旧知识,落实新知识。 |
|
探究浓硫酸的特性 |
[板书]二、浓硫酸的特性: [板书] 1吸水性(干燥剂) [设疑]浓硫酸具有吸水性,常作为干燥剂,那么它能干燥哪些气体呢?不能干燥哪些气体呢? [设疑]为什么H2S、HI、HBr不能用浓硫酸来干燥?带着问题,我们继续学习。 [学生分组实验]在潮湿的纸屑、棉花、木屑中分别滴入几滴浓硫酸。 [提示]皮肤与纸屑、棉花、木屑一样都是有机物,含C、H、O等元素。 [分析]说明浓硫酸让有机物失水变成黑色物质了。下面我们再来做一个“黑面包”实验。 [演示]演示“黑面包”实验:在200mL烧杯中放入20g蔗糖,加入几滴水,搅拌均匀。然后再加入15mL质量分数为98%的浓硫酸,迅速搅拌。观察实验现象。 [提问]生成的黑色固体是什么物质?引导学生写出化学反应方程式。 [小结板书] 2、脱水性(炭化) [设疑]浓硫酸对皮肤有强烈的腐蚀性,如果我们做实验时不慎沾上了浓硫酸怎么办? [引导讨论]以上实验说明了浓硫酸既具有吸水性又具有脱水性,一字之差,请分析比较。 [课后思考]蔗糖碳化后,为什么能形成海绵状的碳,并有刺激性气味的气体产生?要解决这个问题,必须学习硫酸的另外一个非常重要的特性--强氧化性。 [作业] 请同学们课后预习浓硫酸的强氧化性。 |
学生归纳:通常可用浓硫酸干燥的气体有:H2、O2,N2、CO、CO2、CH4、SO2、HCl、C12等: 师生共同小结:不能用浓硫酸干燥的气体有:碱性气体:NH3、还原性气体:H2S、HI、HBr等。 学生实验后,各自回答:三种物质都发生了变化,生成了黑色的物质。 观察并描述:蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的物质;有大量气体冒出;有刺激性气味的气体生成。 思考、回答:黑色物质是碳单质。分析讨论写出化学方程式:  讨论并回答:如皮肤不慎沾上时,应立即用大量水冲洗(勿用手磨擦),然后在患处涂上3%~5%的NaHCO3。 师生共同小结:浓H2SO4吸水性与脱水性的比较(表格见板书设计)。 |
激发学生的求知欲,为后面浓硫酸强氧化性的学习埋下伏笔,留下悬念。 培养观察能力。 培养观察能力与描述现象的能力。 激疑。 回忆对比旧知识,明确内在联系。 揭示反应本质。 加深浓硫酸具有脱水性的认识,学会处理偶发事故,消除恐惧心理。 培养学生概念间的比较能力,认清本质。 回忆前面的实验现象,激发学生继续探索。培养分析解决问题的能力。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com