
2、 氨的化学性质
(1)氨的分子结构:呈三角锥形,极性分子
(2)氨的化学性质
①氨与水的反应

②氨与酸的反应


③氨与氧气的反应(氨催化氧化)

1、 氨的物理性质
无色、有刺激性气味、极易溶于水的气体,比空气轻,易液化。
2.板书纪录
1.教学过程
|
教学过程 |
教师活动 |
学生活动 |
说明 |
|
教学引入 |
[引入] “魔术表演”:空瓶生烟 课前准备两瓶气体,一瓶为HCl,一瓶为NH3,使两瓶相对(HCl在上),抽出玻璃片,则浓烟滚滚,立即充满两瓶。 为什么HCl和NH3混合会出现这样的现象呢?通过本节的学习,我们来寻找答案。 |
仔细倾听,引发好奇心,产生探究兴趣。 |
设置情景,激发学生的好奇心和求知欲。 |
|
氨的物理性质 |
[板书]二、氨 1、 氨的物理性质 [实物展示]装满氨气的烧瓶 [设问]打开装有碳酸氢铵的化肥袋或在炎热的夏季到一些卫生条件很差的公共厕所,常会闻到一股刺激性气味的气体,有时甚至让人睁不开眼,这是什么气体呢? [启发思考]比较氨气(NH3)的式量和空气的平均式量,推测氨的密度是比空气的密度大,还是小? [教师评价并小结]正确。氨的密度确实小于空气的密度,标况下为0.771 g·L-1。 [讲述]氨容易液化,常压下冷却至-33.5℃或在常温加压到700 KPa-800 KPa,气态氨就被液化成无色液体,同时放出大量的热。这倒成了氨气的一大优点,因为当液态氨反过来汽化时,就会吸收大量的热,从而使周围物质的温度急剧下降,故液氨是一种很好的致冷剂。 |
认真观察,了解氨气的颜色、状态并得出结论:氨气是无色的气体。 学生讨论,指出这就是我们这节课要学习的氨气,并得出氨气有刺激性气味。 思考、分析:氨气分子的式量为17,空气的平均式量为29,应该比空气的密度小。 |
培养学生的观察能力,主动探究,激发学生兴趣。 培养学生的比较分析能力,认清本质。 |
|
演示并分析喷泉实验 |
[实验]演示P26课堂实验:氨的喷泉实验(如图所示连接装置) [启发]烧瓶内原先装满了氨气,当用滴管挤进去少量水后,烧杯中的水就喷向烧瓶,形成喷泉,试以物理学的角度分析原因。 [启发]那么为什么烧瓶内的压强会很小很低呢? [设问]这说明什么事实? [教师小结]经测定,在常温常压下,1体积的水中能溶解约700体积的氨气。 [引导思考]此实验成功的关键是什么? 除了喷泉实验之外,你能否再设计一些实验验证氨气极易溶于水的性质?(做为课后研究性课题) [引导小结]请同学们根据前边的观察和讲述总结氨的主要物理性质有哪些? [板书]无色、有刺激性气味、极易溶于水的气体(溶解性:1体积的水中能溶解约700体积),比空气轻,易液化。 [讲述]由于氨对人的眼、鼻、喉等粘膜有刺激作用,接触时应当小心,如果不慎接触过多的氨而感到不适,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。 |
仔细观察,描述观察到的现象,思考形成喷泉的原因。 学生思考:一定是烧瓶内压强远小于大气压强所致。 恍然大悟,氨气肯定是溶解到挤进去的那点水中去了,导致烧瓶压强瞬间变得很小。 学生思考后回答:氨很易溶于水。 学生思考并小结:氨气浓度大、装置密封、烧瓶干燥。 学生回忆、思考并小结。 |
激发好奇心。 培养实验观察能力。 培养逻辑思维能力。 激发求知欲。 提高分析能力 提高分析、归纳小结的能力。 强调安全使用化学药品。 |
|
氨的分子结构 |
[过渡]在讨论了氨的物理性质之后,再来看看氨的化学性质,但往往结构决定性质,所以先来看一下氨的结构特点。 [板书]2、 氨的化学性质 (1)氨的分子结构 [讲述]请用电子式表示氨分子的结构,并让一名学生在黑板上板演。 [实物展示]氨分子球棍模型和比例模型。 [教师小结]经实验测定,氨分子的结构呈三角锥形,氮原子位于锥顶,3个氢原子位于锥底。(氨气分子是极性分子,这是它易溶于水的原因之一)。 [讲述]刚才我们看到喷泉实验的喷泉是什么颜色的?说明了氨溶于水后所形成的溶液显什么性质? |
一位同学上前板演,其余同学书写电子式。  观察分子模型,着重分析氨分子结构特点。 学生思考并回答:红色喷泉,说明氨溶于水后所形成的溶液显碱性。 |
培养学生观察分析能力。 培养推理、综合运用知识的能力。 |
|
氨的化学性质 |
[板书](2)氨的化学性质 ①氨与水的反应 [教师分析]氨溶于水时,大部分NH3和H2O结合形成一水合氨(NH3·H2O),NH3·H2O可以部分电离成OH-和NH  ,因而呈现碱性。NH3·H2O也不稳定,受热易分解为NH3和H2O。 ,因而呈现碱性。NH3·H2O也不稳定,受热易分解为NH3和H2O。[板书]  [引发思考]根据上述反应,请思考氨水中存在哪些微粒? [投影表格]氨水与液氨(见“板书设计”后“附录”) [过渡]氨作为一种碱性气体它还能与酸性的氯化氢气体反应,而且它是咱们所学过的常见气体中,能与酸反应生成盐的气体。 [板书]②氨与酸的反应 [演示实验]P27页课堂实验:用两根玻璃棒分别在浓氨水和浓盐酸里蘸一下,然后将这两根玻璃棒接近。 [教师小结](说明此实验与“空瓶生烟”原理一致)白烟是氨气与HCl化合而生成的微小的NH4Cl晶体。由此也可以知道NH3与酸反应的实质是NH3与H+结合生成NH  的过程。 的过程。[板书]  [讲述]通过NH3和HCl的反应生成氯化铵可知,氨与酸反应的产物应该是对应的铵盐,下边请同学们写出氨与硫酸、硝酸反应的化学方程式。 [评价]讲评板演结果,指出错误或对正确结果予以肯定。 [板书]  [知识拓展] 前边所讨论的氨的性质涉及的反应都是非氧化还原反应,氨中氮元素的化合价没有改变,那么-3价的氮元素是否可以改变呢?在什么情况下可以改变呢?变化时氨表现出氧化性还是还原性? [分析小结]氨中-3价的氮元素化合价是可以升高的,如在催化剂(Pt)的作用下与氧气发生反应生成NO和H2O,并放出热量。 [板书]③氨与氧气的反应(氨催化氧化)  [讲解]这一反应又叫氨的催化氧化(或叫接触氧化)是工业制硝酸中的关键一步,大家课后可以从氧化还原反应的角度分析该反应电子转移的方向、数目,指出氧化剂、氧化产物、还原剂、还原产物。 |
学生思考并小结:存在的微粒主要有NH3、H2O、NH3·H2O、NH  和OH-,当然还有极少量的H+。 和OH-,当然还有极少量的H+。仔细观察并记录现象:当两根玻璃棒接近时,产生较多的白烟。 书写要求的化学反应方程式,其中一名同学在黑板上板演。 学生活动:(思考分析)氨中氮元素为最低价,应该具有还原性,要实现-3价氮元素化合价的升高,就需要提供氧化剂,进一步思考需要哪些氧化剂。 |
培养学生归纳总结能力。 激发好奇心。 培养实验观察、分析能力。 培养学生分析思考问题的能力。 |
|
小结本节内容 |
[小结]本节课我们介绍了氨气的分子结构、物理性质和化学性质。 这些内容是本节的重点。 [作业]P34-35页第2、4、5题。 |
师生共同小结:学习本节,应着重了解氨极易溶于水的性质。与酸(H+)反应生成铵盐。氨分子中氮元素呈-3价,为氮元素之最低价态,只能被氧化,有催化剂存在时可被空气中的氧气氧化为NO。氨水的成分较复杂。 |
学会总结,将知识及时整理,便于理解。 |
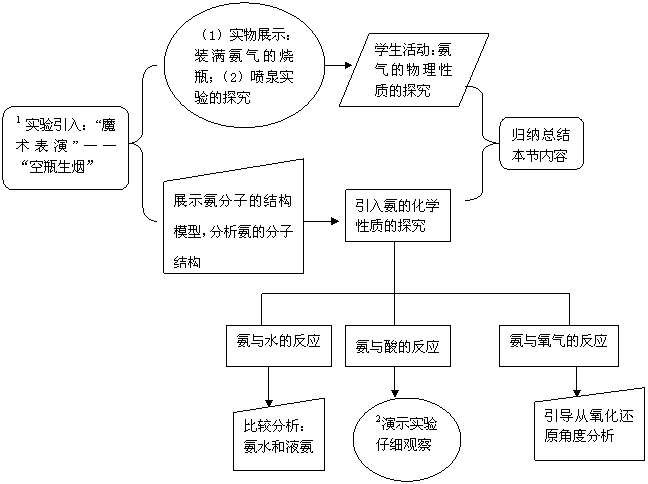
2.流程说明
1实验引入:“魔术表演”-- “空瓶生烟”:课前准备两瓶气体,一瓶为HCl,一瓶为NH3,使两瓶相对(HCl在上),抽出玻璃片,则浓烟滚滚,立即充满两瓶。
2演示实验:用两根玻璃棒分别在浓氨水和浓盐酸里蘸一下,然后将这两根玻璃棒接近。
1.流程图
投影仪、氨分子结构比例模型
铁架台(带铁圈)、玻璃管、滴管、充满氨气的圆底烧瓶、烧杯、橡皮管、夹子、酒精灯、浓氨水、浓盐酸。
氨水跟液氨的差异比较;喷泉实验的操作。
3.情感态度与价值观
领略实事求是的科学态度以及喷泉实验现象的美感。
2.过程与方法
通过实验学生的观察、分析和归纳总结,认识研究问题的科学方法;通过氨的结构、性质和用途相互关系的理解,提高推理能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com