
11.下列各组离子在指定环境中一定能大量共存的是
A.在碳酸氢钠溶液中: K+、Al3+、SO42-、Cl-
B.存在较多Fe3+的溶液中:Na+、SCN-、CO32-、K+
C.常温下由水电离出的C(H+)水·C(OH-)水 = 10-24 溶液中:NH4+、Cl-、CO32-、F-
D.在能使pH试纸变深蓝色的溶液中:Na+ 、S2- 、CO32-、NO3-
10.下列溶液中有关微粒的物质的量浓度的比较正确的是
A.常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液 c(H+):①<②
B.常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:
c(Na+)= c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-)
C.相同条件下,pH=9的①CH3COONa溶液、②NH3·H2O溶液、③NaOH溶液中由水电离出的
c(OH-):①>②>③
D.已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)]
9.下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
8. 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是
2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是
A. 点a的正反应速率比点b的大
B. 点c处反应达到平衡
C. 点d (t1时刻)和点e (t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中的d点值要大
7.恒温恒压下,在容积可变的容器中,反应2NO2(g) N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数( )
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
5.已达化学平衡的下列反应2X(g)+Y(g)===2Z(g)减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
6在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应2R(g)+5Q(g)===4X(g)+nY(g),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中n的值是
A.2 B.3 C.4 D.5
4.10mL pH = 10的KOH溶液中,加入pH = 4的一元酸HA溶液至溶液的pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(H+)=c(OH-) >c(K+) = c(A-)
B.c(H+)=c(OH-) < c(K+) < c(A-)
C.V总≥20mL
D.V总≤20mL
3.室温时,将V1mL c1 mol/L的NaOH溶液滴加到 V2mL c2 mol/L 的醋酸中,下述结论中正确的是
A.若混合溶液的pH=7,则 c1V1 > c2V2
B.若V1=V2 、c1= c2,则混合溶液中 c(Na+) = c(Ac-)
C.若混合溶液的pH=7,则混合溶液中 c(Na+) = c(Ac-)
D.若V1=V2 ,且混合溶液的pH>7,则一定有 c1< c2
2.能够使醋酸溶液的c(H+)减小和醋酸的电离平衡逆向移动的的条件是
A滴加少量H2SO4溶液 B加入少许水稀释
C滴加少量NaOH溶液 D加入少许CH3COONa晶体
1.下列实验与对应的图象符合的是

A.向一定量的CH3COOH溶液
B.向等物质的量的HCl和AlCl3中通入NH3至过量溶液中滴入NaOH溶液至过量
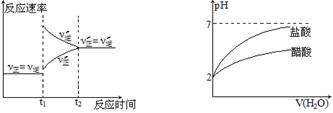
C.对于达到平衡状态的N2(g) +3H2(g)
D.将pH=2的盐酸和醋酸分别加水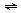 2NH3(g)反应,在t1时缩小容器稀释
2NH3(g)反应,在t1时缩小容器稀释
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com