
每题只有一个选项符合题意,请将正确选项的标号填入题后括号内。
1、下列实验操作的方法中正确的是( )
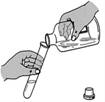

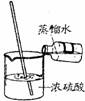
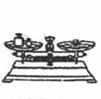
A B C D
19.(15分)奶油中有一种只含C、H、O的化合物A ,A可用作香料,通过质谱仪分析其相对分子质量为88,通过李比希法分析得到A分子中C、H、O原子个数比为2:4:1。
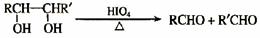 已知: A中含有碳氧双键,与A相关的反应如下:
已知: A中含有碳氧双键,与A相关的反应如下:
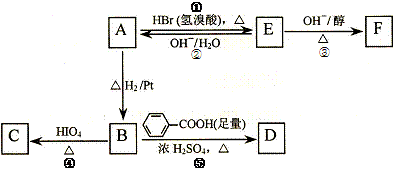
(1)A的分子式为 ,F的结构简式为 。
(2)上述5步反应中属于取代反应的是: (填序号)。
(3)写出B→D反应的化学方程式:_____ __________ _______________。
(4)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的核磁共振氢谱图只有一个吸收峰,写出G的结构简式:________ ________。
泸州市高2010级第二次教学质量诊断性考试
28.(18分)茶是中国人民喜爱的饮品之一。为了定性检验茶叶中含有的Ca、A1、Fe三种元素,某化学兴趣小组的同学设计了如下图流程所示的实验进行检验。他们查阅文献资料知道: ①草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。
②Ca2+、A13+、Fe3+三种离子分别完全沉淀成为金属氢氧化物时溶液的pH为:
Ca(OH)2:pH≥13; A1(OH)3:pH≥5.5; Fe(OH)3:pH≥4.1
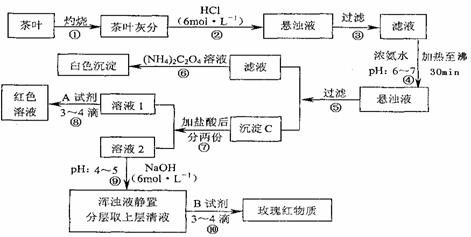
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 ____ 。
(2)实验中检验Ca2+的离子方程式 ___ 。
(3)沉淀C中所含主要物质的化学式 。
(4)步骤⑧用A试剂生成红色溶液的离子方程式 ___ 。
(5)步骤⑨的作用是 _________ _ ;请你猜测步骤⑩的目的是 。
27.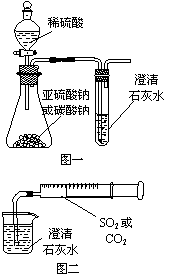 (12分)某同学用如图一所示的装置来探究CO2、SO2
(12分)某同学用如图一所示的装置来探究CO2、SO2
与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2时产生现象明显比通入CO2快。
(1) 对比分析两组实验,你认为用图一装置实验时,通
入SO2不能出现浑浊的原因可能是
。
(2) 用图二装置实验时,以相同速率通入CO2或SO2,
SO2产生浑浊、澄清的现象比CO2快的原因是
。
(3) 用图一进行SO2与石灰水反应的实验时,装置是否
存在缺点?_ (填“是”或“否” )应做何改进?
。
26.(15分)A物质的微粒是由四个原子构成的分子,其中共有22个电子,A可溶解在水中;由A分解所得B、C的物质的量之比为1:3,B、C为常见的气态单质;甲、乙为金属单质,常温下乙不能溶解在H的浓溶液中;G、I的溶液均呈碱性。一定条件下各物质间的转化关系如下:
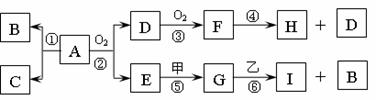
(1)单质C的电子式 。
(2)A极不稳定,受撞击时立即发生分解反应且放出大量热而爆炸;A的水溶液呈弱酸性。
①从反应热的角度分析,通常状况下能否由B、C化合成A
;
②写出Zn与A的水溶液反应的化学方程式: 。
(3)反应④中每消耗1molF,转移电子的物质的量为 ;反应⑥的离子方程式是 。
13.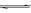 现有反应A2+B2 2AB;在温度和压强可变条件下。产物AB的生成情况如图所示:a为500℃,b为300℃,从t3开始压缩容器,则下列叙述正确的是
现有反应A2+B2 2AB;在温度和压强可变条件下。产物AB的生成情况如图所示:a为500℃,b为300℃,从t3开始压缩容器,则下列叙述正确的是
 A.AB为气体,A2、B2中必有一种为非气体;正反应放热
A.AB为气体,A2、B2中必有一种为非气体;正反应放热
B.A2、B2、AB均为气体;正反应吸热
C.AB为固体,A2、B2中必有一种为非气体;正反应放热
D.AB为气体,A2、B2中必有一种为非气体;正反应吸热
12.下列的对实验现象的解释与结论正确的是
|
编号 |
实验操作 |
实验现象 |
解释与结论 |
|
A |
向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 |
有白色沉淀产生 |
蛋白质发生了变性 |
|
B |
向某溶液中加入BaCl2溶液 |
有白色沉淀产生 |
生成难溶于水的BaSO4,该溶液中一定含有SO42- |
|
C |
向苯中滴入少量浓溴水,振荡,静置 |
溶液分层,上层呈橙红色,下层几乎无色 |
苯和溴水发生取代反应,使溴水褪色 |
|
D |
向蔗糖中加入浓硫酸 |
蔗糖变黑,体积膨胀,放热并放出刺激性气味气体 |
浓硫酸有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
10. 下列离子方程式正确的是
下列离子方程式正确的是
 A.漂白粉溶液在空气中失效:
A.漂白粉溶液在空气中失效: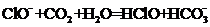
 B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
 C. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
C. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
 D. 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
D. 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2+ + 2OH- + NH4+ + HCO3- = BaCO3↓+ NH3·H2O + H2O


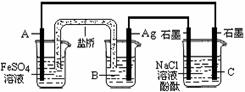 11.利用反应:2Ag+(aq)
+ Fe(s) == Fe2+(aq) +2Ag(s)
11.利用反应:2Ag+(aq)
+ Fe(s) == Fe2+(aq) +2Ag(s)
设计原电池并用它作电源进行电解的装置如图所示。
NaCl溶液的体积为200mL,假设反应产生的气体全
部放出,且反应前后溶液体积的变化忽略不计。
下列有关叙述中错误的是
A.电极A应该用Fe作材料, B是AgNO3溶液,电极C周围溶液变红
B.A、C两极都发生氧化反应,C电极反应式为:2H++2e-=H2
C.银电极变粗,为电源的正极,A电极反应式为:Fe-2e-= Fe2+
D.当析出Ag21.6g时,NaCl溶液的pH是反应前的2倍
9.室温下,甲溶液中水电离出的H+浓度为10-12mol/L,乙溶液中水电离出的H+浓度为
10-2 moL/L,下列说法正确的是
A.甲乙两溶液的pH不可能相同
B.甲乙两种溶液中加入Al粉都一定会产生H2
C.HSO3-不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液,乙不可能是酸或碱溶液
8.下列叙述中完全正确的一组是
①常温常压下,1 mol乙基(-CH2CH3)所含的电子数为18NA
②1 molC10H22分子中共价键总数为31NA
③常温常压下,16 g O3所含的原子数为NA
④由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2g H2,则电路中通过的电子数为0.2NA
⑤在标准状况下,11.2L NO与11.2L O2混合后气体分子数为0.75NA
⑥1 molCl2发生反应时,转移的电子数一定是2NA
⑦标准状况下,22.4L H2O中含分子数为NA
A.①②③④⑤ B.②④⑤⑥⑦ C. ②③④ D.①②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com