

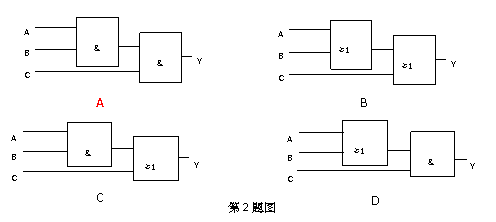
2.一个机要仓库有一扇电动门,门上有三把锁,三个机要员各有一把锁的钥匙,只有三人同时转动自己的钥匙(闭合自己的开关),才能通过继电器把门打开。下列能实现上述要求的门电路是
1.两个质量均为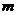 的完全相同的金属球a和
的完全相同的金属球a和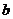 ,其质量分布均匀,将它们
,其质量分布均匀,将它们 固定
固定 于绝缘支座上,两球心间的距离
于绝缘支座上,两球心间的距离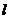 为球半径的3倍。若使它们带上等量异种电荷,所带电荷量的绝对值均为Q,那么a、b两球之间的万有引力F引和库仑力F库的表达式正确的是
为球半径的3倍。若使它们带上等量异种电荷,所带电荷量的绝对值均为Q,那么a、b两球之间的万有引力F引和库仑力F库的表达式正确的是
A.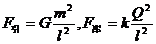 B.
B.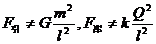
C.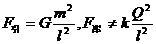 D.
D. 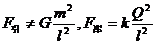
16.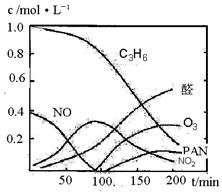 (10分)汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线。结合曲线,试回答下列问题。
(10分)汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线。结合曲线,试回答下列问题。
(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理
▲ 。
(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0-100min内,平均反应速率最大的是:
▲ (选填:C3H6、NO、NO2、醛、O3、PAN)
(3)已知: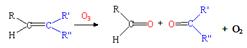 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平) ▲ 。
,写出丙烯与臭氧作用生成醛的化学方程式(并配平) ▲ 。
(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法。在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为: ▲ 。
(5)2000K时,可以发生如下反应:
1/2N2+1/2O2 NO, K1
NO, K1
1/2N2+O2 NO2, K2
NO2, K2
4NO 2NO2+N2,该反应的平衡常数K3= ▲ (用K1、K2表示)。
2NO2+N2,该反应的平衡常数K3= ▲ (用K1、K2表示)。
17(12分).雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:
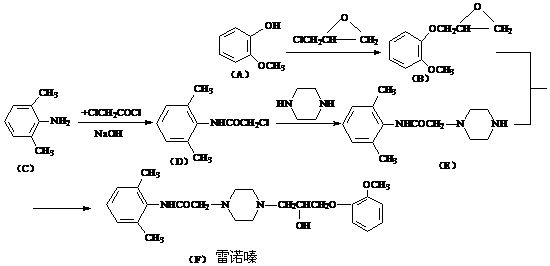
(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称: ▲ 、 ▲ 。
(2)写出满足下列条件A的同分异构体的数目 ▲ 。
①A能与FeCl3溶液发生显色反应;②1molA可与2molNaOH反应。
(3)C→D中,加入适量NaOH的作用是: ▲ 。
(4)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。
已知: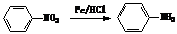
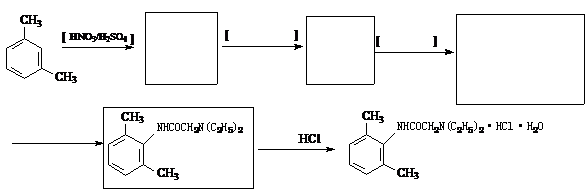
18(10分).据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油的替代品。研究发现,如果使用铁作催化剂,二氧化碳与氢气反应产生30%的甲烷,其余的短链烃可以被用来提炼燃料。
(1)为延缓全球温室效应,二氧化碳捕获和封存技术(CCS)是当今化学的前沿技术,下列通过化学反应捕获二氧化碳的反应,其原子利用率达100%的是 ▲ 。
(a)CO2 +CaO  CaCO3
CaCO3
(b)K2CO3+CO2+H2O=2KHCO3
(c)2Mg+CO2 2MgO+C
2MgO+C
(d)
(2)用二氧化碳合成烃,需要提供辅助原料氢气,下列制取氢气的方法可行且二氧化碳零排放的是 ▲ 。
(a)用太阳能光解海水制氢 (b)利用天然气与水高温催化制氢
(c)利用活泼金属与海水反应制氢 (d)利用核反应堆多余的电能电解海水制氢
(3)所谓FT合成,就 是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
(4)某文献报道:在300℃、30MPa,以Fe、CoCl2作催化剂条件下,CO2和H2反应生成丁烷和戊烷。
①假定在一实验容器中充入一定量的CO2和H2,加入 催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
②据问题①,今有标准状况下的CO2448L, n(丁烷)/n(戊烷) =x,消耗H2的物质的量为y,则y= ▲ (用x表示)。
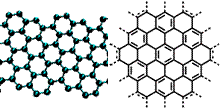 19(12分)A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
19(12分)A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
(1)下列有关石墨烯说法正确的是 ▲ 。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
 (2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金 、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为: ▲ 。
②乙醇沸点比氯乙烷高,主要原因是 ▲ 。
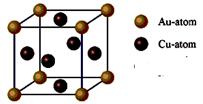
③右图是金与铜形成的金属互化物合金,它的化学式可表示为: ▲ 。
④含碳源中属于非极性分子的是 ▲ (a.甲烷 b.乙炔 c.苯 d.乙醇)
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:
▲ ;酞菁铜分子中心离子的配位数为: ▲ 。

19B.硫酸钾是重要的化工产品,生产方法很多,如曼海姆法、石膏两步转化法等。

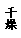
(1)本实验中,采用抽滤方法,图中A、B两仪器名称分别为: ▲ 、 ▲ 。
(2)在一部转化反应器中发生的反应为:CaSO4·2H2O+2NH4HCO3=(NH4)2SO4+CaCO3+CO2↑+3H2O,该步反应温度必须低于35℃,其主要目的是 ▲ 。
(3)在两步转化反应器中发生反应的化学方程式为 ▲ 。
(4)两步转化反应器中用乙二醇代替水作溶剂,其目的是 ▲ 。
(5)磷石膏主要成分为二水硫酸钙(CaSO4•2H2O) ,还含有未分解的磷矿, 未洗涤干净的磷酸、氟化钙、铁铝氧化物等,欲检验母液中含Fe3+,可用亚铁氰化钾溶液检验,该检验反应的离子方程式为: ▲ 。
(6)该法优点除K2SO4产率高外,再列举一个优点 ▲  。
。
盐城市2010届高三第一次调研考试
化学试题答案及评分标准
13(12分).
(1)H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度(2分).
(2)c(1分)(3)①酸(1分);②2,5,6=2,8, 5O2;(2分)③13.3%(2分);
④偏高(2分) ⑤尿素(写水杨酸稳定剂也得分)(2分)
14(12 分).
分).
(1)Ⅰ、Ⅲ(2分) (2)分馏(蒸馏)(2分)
(3)Ca3(PO4)2+5C+3SiO2 3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
(4)SiHCl3会水解,同时产生的H2,与O2混合发生爆炸等(2分)
(5)CH3OH+H2O-6e-=CO2+6H+(2分)
15(10分).
(1)①不能(2分);②-970.2(2分);③除去其中的过量的钠并溶解氯化钠及钛的低价氯化物(1分)
(2)①TiO2 +4e- = Ti +O2-(或:Ca2++2e-=Ca ,2Ca+TiO2 = 2CaO +Ti)(2分)
②H2(1分)(3)d(2分)
16(10分).
(1)b(2分) (2)NO(2分)
(3)CH3CH=CH2+2O3→CH3CHO+HCHO+2O2 (2分)
(4)4NH3+6NO 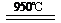 5N2+6H2O(2分)(5)K22/K14(2分)
5N2+6H2O(2分)(5)K22/K14(2分)
17(12分).(1)羟基、醚键(2分,) (2)6 (2分)
(3)与取代产物HCl作用,使平衡向生成D的方向移动,提高D的产率(2分)。
(4)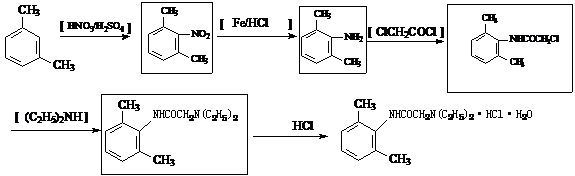
(每空1分,共6分)
18(10分).
(1)abd(2分,选对1个或2个得1分,多选错选不得分)
(2)ad(2分,选对1个得1分,多选错选不得分)
(3)8CO2
+ 20H2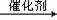 C8H18
+16H2O(2分)
C8H18
+16H2O(2分)
(4)①3.2<a<3.25 (2分) ②(260x+320)/(4x+5)(2分)
19(12分).
A.
(1)BD(2分,选对1个得1分,多选错选不得分)
(2)①[ Ar]3d74s2 (2分) ②乙醇分子间可形成氢键,而氯乙烷分子间无氢键(1分);
Ar]3d74s2 (2分) ②乙醇分子间可形成氢键,而氯乙烷分子间无氢键(1分);
③Cu3 Au或Au Cu3 (1分) ④a、b、c(2分)⑤sp3和sp2 (2分) ;2(2分)
B.
(1)布氏漏斗;安全瓶 (各1分,共2分)
(2)防止NH4HCO3分解(2分)
本卷中所有合理答案均酌情给分。
(3)(NH4)2SO4+2KCl=K2SO4+2NH4Cl(2分)
(4)降低K2SO4溶解度,有利于K2SO4析出,提高产率(2分)
(5)Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓(2分)
(6)原料得到充分利用,同时得到副产品化肥等(2分)
12. 取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s) =R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s) =R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正 确的是
确的是
A.常温下,0.0025mol/LNaOH溶液 pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,
PbI2的Ksp减小
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI
浓溶液 ,离子浓度变化如右图所示。
,离子浓度变化如右图所示。
D.本次实验测得的t℃ PbI2的Ksp=4×10-9
第Ⅱ卷(非选择题 共78分)
13(12分).过氧化尿素[CO(NH2)2·H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:
 试回答下列问题:
试回答下列问题:
(1)实际生产中需控制n(H2O2)∶n[CO(NH2)2]=1.2∶1,并控制合成温度在25-30℃,其主要原因是 ▲ 。
(2)从母液中分离出H2O2和尿素,采用的操作是 ▲ 。
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol/L的硫酸,然后用0.2000mol/LKMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KmnO4溶液与尿素不反应)。
①KMnO4溶液应盛放在 ▲ 式(选填:“酸”、“碱”)滴定管中。
②完成并配平方程式:MnO4-+H2O2+H+=Mn2++H2O+
③根据滴定结果,可确定产品中活性氧的质量分数为: ▲ 。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 ▲ . (选填:“偏高”、“偏低”或“不变”)。
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为▲ 。
14(12分).由磷矿石、石英、氯化氢等为原料生产白炭黑(SiO2·nH2O)、磷及甲醇,下列工艺过程原料综合 利用率高,废弃物少。
利用率高,废弃物少。
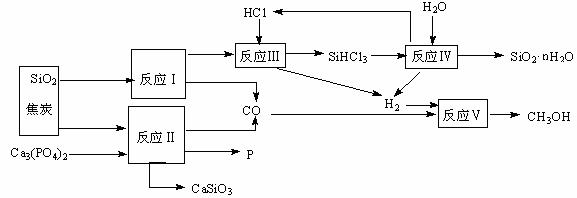
(1)上述反应中,属于置换反应的是 ▲ (选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(2)已知SiHCl3的沸点为33.0℃,提纯SiHCl3适宜的方法是 ▲ 。
(3)高温下进行的反应Ⅱ的化学方程式为: ▲ ;固体废弃物CaSiO3可用于 ▲ 。
(4)反应Ⅲ需在高温、隔绝氧气和无水条件下进行,其原因是 ▲ 。
(5)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 ▲ 。
15(10分).钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用。但在较高温度下,钛可与多种单质和化合物发生反应。工业上冶炼钛主要以钛铁矿、金红石(含TiO2大于96%)等为原料生产。
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
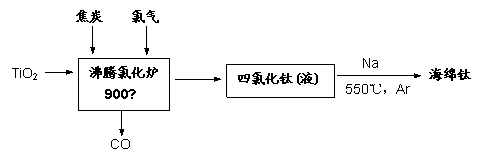 ①沸腾氯化炉中反应:TiO2(s)
+2Cl2 (g)=TiCl4(l) + O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S =57.74J/K) ▲ (选填:“能”或“不能”)。
①沸腾氯化炉中反应:TiO2(s)
+2Cl2 (g)=TiCl4(l) + O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S =57.74J/K) ▲ (选填:“能”或“不能”)。
②已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol
Na(s) = Na(l) △H =2.6 kJ/mol
则TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = ▲ kJ/mol
③海绵钛破碎后用0.5%-1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的
▲ 。
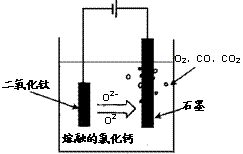 (2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,阴极获得钛可能发生的反应或电极反应为: ▲ 。
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体是 ▲ 。
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为:
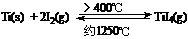 ,下列说法正确的是 ▲ 。
,下列说法正确的是 ▲ 。
(a) 该反应正反应为的△H>0
(b) 在不同温度区域,Ti I4 的量保持不变
I4 的量保持不变
(c) 在提纯过程中,I2 的量不断减少
(d) 在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
3.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.3.6g碳与3.36LO2一定条件下恰好完全反应,生成CO分子数一定为0.3 NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.25℃时, 0.15mol/L的Na2CO3溶液中,Na+数目为0.3NA
D.标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA
16. (10分)汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线。结合曲线,试回答下列问题。
(10分)汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线。结合曲线,试回答下列问题。
(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理
▲ 。
(a)臭氧层破损坏 (b)光化学烟雾
(c)酸雨的形成 (d)白色污染
(2)0-100min内,平均反应速率最大的是:
▲ (选填:C3H6、NO、NO2、醛、O3、PAN)
(3)已知: ,写出丙烯与臭氧作用生成醛的化学方程式(并配平) ▲ 。
,写出丙烯与臭氧作用生成醛的化学方程式(并配平) ▲ 。
(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法。在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为: ▲ 。
(5)2000K时,可以发生如下反应:
1/2N2+1/2O2 NO, K1
NO, K1
1/2N2+O2 NO2, K2
NO2, K2
4NO 2NO2+N2,该反应的平衡常数K3= ▲ (用K1、K2表示)。
2NO2+N2,该反应的平衡常数K3= ▲ (用K1、K2表示)。
17(12分).雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:

(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称: ▲ 、 ▲ 。
(2)写出满足下列条件A的同分异构体的数目 ▲ 。
①A能与FeCl3溶液发生显色反应;②1molA可与2molNaOH反应。
(3)C→D中,加入适量NaOH的作用是: ▲ 。
(4)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。
已知: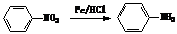
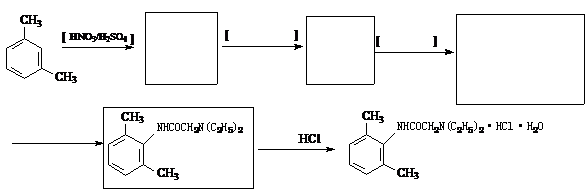
18(10分).据报道:美国海军科学家拟提取海水中溶解的二氧化碳,利用类似FT合成的方法生产短链不饱和烃,以作为汽油的替代品。研究发现,如果使用铁作催化剂,二氧化碳与氢气反应产生30%的甲烷,其余的短链烃可以被用来提炼燃料。
(1)为延缓全球温室效应,二氧化碳捕获和封存技术(CCS)是当今化学的前沿技术,下列通过化学反应捕获二氧化碳的反应,其原子利用率达100%的是 ▲ 。
(a)CO2 +CaO  CaCO3
CaCO3
(b)K2CO3+CO2+H2O=2KHCO3
(c)2Mg+CO2 2MgO+C
2MgO+C
(d)
(2)用二氧化碳合成烃,需要提供辅助原料氢气,下列制取氢气的方法可行且二氧化碳零排放的是 ▲ 。
(a)用太阳能光解海水制氢 (b)利用天然气与水高温催化制氢
(c)利用活泼金属与海水反应制氢 (d)利用核反应堆多余的电能电解海水制氢
(3)所谓FT合成,就 是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
是CO在金属催化剂上催化氢化反应,生成以直链烷烃和烯烃为主的混合物的过程。CO2与H2合成汽油(平均组成设为C8H18)反应的化学方程式为: ▲ 。
(4)某文献报道:在300℃、30MPa,以Fe、CoCl2作催化剂条件下,CO2和H2反应生成丁烷和戊烷。
①假定在一实验容器中充入一定量的CO2和H2,加入 催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
催化剂,若CO2和H2转化率均为100%,产物只有丁烷和戊烷, n(H2)/n(CO2)=a,a取值范围为: ▲ 。
②据问题①,今有标准状况下的CO2448L, n(丁烷)/n(戊烷) =x,消耗H2的物质的量为y,则y= ▲ (用x表示)。
 19(12分)A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
19(12分)A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右:
(1)下列有关石墨烯说法正确的是 ▲ 。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
 (2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金 、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为: ▲ 。
②乙醇沸点比氯乙烷高,主要原因是 ▲ 。
③右图是金与铜形成的金属互化物合金,它的化学式可表示为: ▲ 。
④含碳源中属于非极性分子的是 ▲ (a.甲烷 b.乙炔 c.苯 d.乙醇)
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:
▲ ;酞菁铜分子中心离子的配位数为: ▲ 。

19B.硫酸钾是重要的化工产品,生产方法很多,如曼海姆法、石膏两步转化法等。



(1)本实验中,采用抽滤方法,图中A、B两仪器名称分别为: ▲ 、 ▲ 。
(2)在一部转化反应器中发生的反应为:CaSO4·2H2O+2NH4HCO3=(NH4)2SO4+CaCO3+CO2↑+3H2O,该步反应温度必须低于35℃,其主要目的是 ▲ 。
(3)在两步转化反应器中发生反应的化学方程式为 ▲ 。
(4)两步转化反应器中用乙二醇代替水作溶剂,其目的是 ▲ 。
(5)磷石膏主要成分为二水硫酸钙(CaSO4•2H2O) ,还含有未分解的磷矿, 未洗涤干净的磷酸、氟化钙、铁铝氧化物等,欲检验母液中含Fe3+,可用亚铁氰化钾溶液检验,该检验反应的离子方程式为: ▲ 。
(6)该法优点除K2SO4产率高外,再列举一个优点 ▲  。
。
盐城市2010届高三第一次调研考试
化学试题答案及评分标准
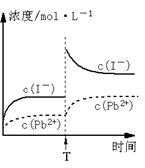
13(12分).
(1)H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度(2分).
(2)c(1分)(3)①酸(1分);②2,5,6=2,8, 5O2;(2分)③13.3%(2分);
④偏高(2分) ⑤尿素(写水杨酸稳定剂也得分)(2分)
14(12 分).
分).
(1)Ⅰ、Ⅲ(2分) (2)分馏(蒸馏)(2分)
(3)Ca3(PO4)2+5C+3SiO2 3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
3CaSiO3+2P+5CO↑(2分);生产水泥、砖瓦或作为建筑材料等(2分)
(4)SiHCl3会水解,同时产生的H2,与O2混合发生爆炸等(2分)
(5)CH3OH+H2O-6e-=CO2+6H+(2分)
15(10分).
(1)①不能(2分);②-970.2(2分);③除去其中的过量的钠并溶解氯化钠及钛的低价氯化物(1分)
(2)①TiO2 +4e- = Ti +O2-(或:Ca2++2e-=Ca ,2Ca+TiO2 = 2CaO +Ti)(2分)
②H2(1分)(3)d(2分)
16(10分).
(1)b(2分) (2)NO(2分)
(3)CH3CH=CH2+2O3→CH3CHO+HCHO+2O2 (2分)
(4)4NH3+6NO 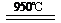 5N2+6H2O(2分)(5)K22/K14(2分)
5N2+6H2O(2分)(5)K22/K14(2分)
17(12分).(1)羟基、醚键(2分,) (2)6 (2分)
(3)与取代产物HCl作用,使平衡向生成D的方向移动,提高D的产率(2分)。
(4)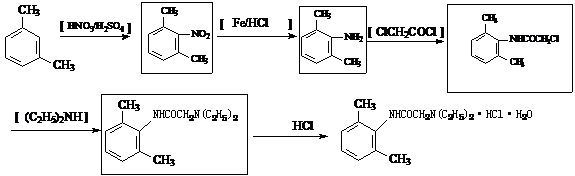
(每空1分,共6分)
18(10分).
(1)abd(2分,选对1个或2个得1分,多选错选不得分)
(2)ad(2分,选对1个得1分,多选错选不得分)
(3)8CO2
+ 20H2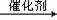 C8H18
+16H2O(2分)
C8H18
+16H2O(2分)
(4)①3.2<a<3.25 (2分) ②(260x+320)/(4x+5)(2分)
19(12分).
A.
(1)BD(2分,选对1个得1分,多选错选不得分)
(2)①[ Ar]3d74s2 (2分) ②乙醇分子间可形成氢键,而氯乙烷分子间无氢键(1分);
Ar]3d74s2 (2分) ②乙醇分子间可形成氢键,而氯乙烷分子间无氢键(1分);
③Cu3 Au或Au Cu3 (1分) ④a、b、c(2分)⑤sp3和sp2 (2分) ;2(2分)
B.
(1)布氏漏斗;安全瓶 (各1分,共2分)
(2)防止NH4HCO3分解(2分)
本卷中所有合理答案均酌情给分。
(3)(NH4)2SO4+2KCl=K2SO4+2NH4Cl(2分)
(4)降低K2SO4溶解度,有利于K2SO4析出,提高产率(2分)
(5)Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓(2分)
(6)原料得到充分利用,同时得到副产品化肥等(2分)
盐城市2010届高三第一次调研考试
化学试题
第Ⅰ卷 (选择题共42分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
12. 取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s) =R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s) =R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。结合上述实验数据(已知lg2=0.3),下列有关说法正 确的是
确的是
A.常温下,0.0025mol/LNaOH溶液 pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,
PbI2的Ksp减小
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI
浓溶液 ,离子浓度变化如右图所示。
,离子浓度变化如右图所示。
D.本次实验测得的t℃ PbI2的Ksp=4×10-9
第Ⅱ卷(非选择题 共78分)
13(12分).过氧化尿素[CO(NH2)2·H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域。其合成如下:
 试回答下列问题:
试回答下列问题:
(1)实际生产中需控制n(H2O2)∶n[CO(NH2)2]=1.2∶1,并控制合成温度在25-30℃,其主要原因是 ▲ 。
(2)从母液中分离出H2O2和尿素,采用的操作是 ▲ 。
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol/L的硫酸,然后用0.2000mol/LKMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KmnO4溶液与尿素不反应)。
①KMnO4溶液应盛放在 ▲ 式(选填:“酸”、“碱”)滴定管中。
②完成并配平方程式:MnO4-+H2O2+H+=Mn2++H2O+
③根据滴定结果,可确定产品中活性氧的质量分数为: ▲ 。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 ▲ . (选填:“偏高”、“偏低”或“不变”)。
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为▲ 。
14(12分).由磷矿石、石英、氯化氢等为原料生产白炭黑(SiO2·nH2O)、磷及甲醇,下列工艺过程原料综合 利用率高,废弃物少。
利用率高,废弃物少。

(1)上述反应中,属于置换反应的是 ▲ (选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(2)已知SiHCl3的沸点为33.0℃,提纯SiHCl3适宜的方法是 ▲ 。
(3)高温下进行的反应Ⅱ的化学方程式为: ▲ ;固体废弃物CaSiO3可用于 ▲ 。
(4)反应Ⅲ需在高温、隔绝氧气和无水条件下进行,其原因是 ▲ 。
(5)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 ▲ 。
15(10分).钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用。但在较高温度下,钛可与多种单质和化合物发生反应。工业上冶炼钛主要以钛铁矿、金红石(含TiO2大于96%)等为原料生产。
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
 ①沸腾氯化炉中反应:TiO2(s)
+2Cl2 (g)=TiCl4(l) + O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S =57.74J/K) ▲ (选填:“能”或“不能”)。
①沸腾氯化炉中反应:TiO2(s)
+2Cl2 (g)=TiCl4(l) + O2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S =57.74J/K) ▲ (选填:“能”或“不能”)。
②已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0kJ/mol
Na(s) = Na(l) △H =2.6 kJ/mol
则TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = ▲ kJ/mol
③海绵钛破碎后用0.5%-1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的
▲ 。
 (2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,阴极获得钛可能发生的反应或电极反应为: ▲ 。
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体是 ▲ 。
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为:
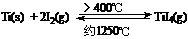 ,下列说法正确的是 ▲ 。
,下列说法正确的是 ▲ 。
(a) 该反应正反应为的△H>0
(b) 在不同温度区域,Ti I4 的量保持不变
I4 的量保持不变
(c) 在提纯过程中,I2 的量不断减少
(d) 在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
11.下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,0.1mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-) >c(H2C2O4)>c(C2O42-)
B.NaHCO3溶液:c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
C.25℃时,pH=9、浓度均为0.1 mol/L的NH3·H2O、NH4Cl混合溶液:
c(NH4+)+c(H+)>c(NH3·H2O)+c(OH-)
D.0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
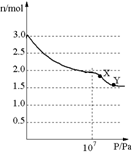
10.将3molNO放入密闭容器中,50℃时恒温加热,然后加压,气体总物质的量随压强变化如右图所示,下列说法正确的是
A.在X、Y两点,反应速率υ(X)=υ(Y)
B.压强小于107Pa,主要发生的反应为:2NO=N2+O2
C.X点→Y点,可能发生的反应为:2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
D.整个过程中可能发生的反应为:3NO=N2O+NO2, 2NO2(g) N2O4(g)
N2O4(g)
9.下列离子方程式书写不正确的是
A.用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
B.碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2:
4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O
 D.用硫酸酸化的桔红色的重铬酸钾(K2 Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:
D.用硫酸酸化的桔红色的重铬酸钾(K2 Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:
2Cr2O72-+ 3C2H5OH + 16H+ → 4Cr3+ + 3CH3COOH + 11H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com