
0.005mol n(HCl) V(HCl)=0.112L=112mL
n(HCl)=0.005mol 答:能生成的氢气为112毫升。
V(HCl)=n(HCl)×Vm=0.005×22.4=0.112L=112mL
答:能生成的氢气在标准状况下为112毫升。
[教师活动]大家认为以上哪种解法更简单呢?
[学生活动]回答,第二种简单。
[教师活动]讲解:当然第二种比较简单,但是要这样来解题,还需要大家多多练习,熟练掌握,特别在列比例式时应注意,不同物质使用的单位可以不同,但要相应,同一物质使用的单位必须一致.接下来我们做一题试试:
[投影]练习1:现有MnO2 8.7g,与浓盐酸共热,问最多能产生多少升Cl2(S.T.P)?
[学生活动]练习,(注:可请二位解题方法不同的学生上台解题)
[学生解题]解法略(同例题的解法)
[讲解]当然,本题的解答过程上还不止这一种,这说明:解答同一个问题可以通过不同的途径.希望大家在以后的学习中能多动脑筋,多想些方法,以促使自己的思维能力能更上一层楼。
(2)过量计算:
[情景引入]
[教师提问]大家还记得工业上是如何制得盐酸的吗?制1mol氯化氢是分别用0.5mol的氯气和氢气吗?
[学生活动]回忆思考,指出是用氯气和氢气化合来制得的并且了解到化工生产中的反应物会投入过量,以使得有毒物质反应完全。
[教师活动]提出过量计算问题。
[投影]例2:某化工厂生产盐酸,每天耗用氯气42.6t,氢气1.45t,问该厂理论上每天最多能生产31%的盐酸多少吨?
[提问]碰到这种情况时我们该如何来计算呢?
[学生活动]回忆起过量问题,指出要先算算反应物中谁用过量了?
[学生活动]计算,发现过量的是氢气。
[提问]这时候应该用哪一个物质来进行化学计算呢?
[学生活动]思考,得出结论:用氯气来计算(此时:教师要强调:由于过量的物质实际上不参与反应,因此投入量少的物质反应完全,用量少的物质来进行化学计算)
[讲解兼总结]过量计算的步骤:1.写出化学方程式,找出反应物的化学计量数关系
3.物质的量、质量、气体体积等物理量在化学方程式计算中的应用
(1)常规计算:
[讲解]从上题中我们发现,实际上,我们在运用有关化学方程式的计算解决问题时,除了涉及有关物质的物质的量外,还经常涉及到物质的质量、体积等物理量的综合计算.这就需要进行必要的换算.而换算的核心就是--物质的量.接下去就让我们来具体研究一下:
[投影] H2+Cl2→2HCl
化学计量数比
粒子数之比
物质的量比
物质的质量比
气体体积比
(注:这一部分内容的教学设计:学生口答,教师把各物理量的比值进行投影。它们依次是:1∶1∶2;1∶1∶2;1∶1∶2;2∶71∶73;1∶1∶2)
[讲解]从中我们发现有了物质的量,我们很容易地就把微观的微粒数(化学计量数)与宏观物质的质量、体积都联系起来了,我们可以按需来使用它们。
[投影]练习标准状况下,能否这样表达参加化学反应的各物质的量的关系:
2CO + O2 → 2CO2
2mol 32g 44.8L(S.T.P)
[讲解]根据化学方程式所反映出的这些关系,可以进行多种计算.但要根据题意,明确已知条件是什么,求解什么,从而合理选择比例量的单位。
[投影并讲解]接下来,我们来看看例题的解法:
解法一: 解法二:
(1)Mg的摩尔质量是24g/mol Mg + 2HCl → MgCl2 +H2↑
n(Mg)=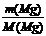 =
=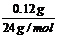 =0.005mol
24g
22.4L
=0.005mol
24g
22.4L
(2)Mg + 2HCl → MgCl2 +H2↑ 0.12g V(HCl)
1mol
1mol
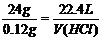
2.引入新课
[投影]例一:在实验室里用0.12g镁带和足量的盐酸反应,能生成的氢气在标准状况下为多少毫升?
[教师活动]指导学生了解高中化学计算的要求:掌握物质的量、物质的质量、气体摩尔体积在化学方程式中的综合计算。
2、计算方法
 [教师活动]a、投影 Cl2 +
2KBr
2KCl + Br2
[教师活动]a、投影 Cl2 +
2KBr
2KCl + Br2
化学计量数: 1个 2个 2个 1个
×NA : NA个 2NA个 2NA个 NA个
物质的量: 1mol 2mol 2mol 1mol
在化学方程式中:计量数之比=参加反应的物质的微粒个数比=反应物质的物质的量之比
b、请一位学生上台来解题,借此机会复习解题步骤和格式。
1、化学方程式中计量数之比=参加反应的物质的微粒个数比=反应物质的物质的量之比
1.复习回顾
[投影]溴在工业上是十分重要的原料,假设在1L苦卤中有Brˉ0.1mol,则提取溴时,氯气的用量能否大大过量?具体该加多少摩尔氯气?
[学生活动]解题、回顾原有知识:
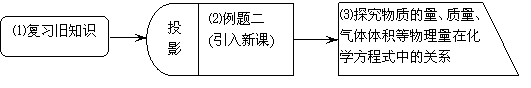
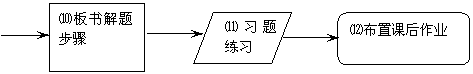
3.流程图说明
(1)通过投影:“溴在工业上是十分重要的原料,假设在1L苦卤中有Brˉ0.1mol,则提取溴时,氯气的用量能否大大过量?具体该加多少摩尔氯气?”这一问题,让学生思考解题方法,复习“物质的量与化学方程式的关系”以及物质的量在化学方程式中的简单应用
(2)此步骤通过题目:“例2:在实验室里用0.12g镁带和足量的盐酸反应,能生成的氢气在标准状况下为多少毫升?”让学生了解在高中阶段运用有关化学方程式的计算解决问题时,除了涉及有关物质的物质的量外,还经常涉及到物质的质量、体积等物理量。学生必须掌握必要的换算方法。
(3)(4)(5)本内容通过a、对氯气、氢气的化合反应中各物理量的分析,归纳物质的量、质量、气体体积等物理量在化学方程式中的关系(方法略)
b、通过练习(略)加深理解、巩固。
c、例题分析(通过两种解题方法的呈现,使学生掌握如何解题,了解解题方法的多样性,分析哪种方法更简便)
(6)[投影]练习1:现有MnO2 8.7g,与浓盐酸共热,问最多能产生多少升Cl2(S.T.P)?
活动建议:学生在座位上解题,找出二位解题方法不同的学生上讲台,在黑板上解题,教师从旁指导在列比例式时应注意,不同物质使用的单位可以不同,但要相应,同一物质使用的单位必须一致。解答同一个问题可以通过不同的途径并鼓励学生在以后的学习中能多动脑筋,多想些方法。
(7)(8)通过指导学生回顾工业制盐酸的方法,思考生产中氢气、氯气的投放量多少以及原因,使学生了解化学反应中投入的反应物恰好完全反应的情况是较少见的,因此过量计算将比较常见。
(9)(10)通过投影问题“例3:某化工厂生产盐酸,每天耗用氯气42.6t,氢气1.45t,问该厂理论上每天最多能生产31%的盐酸多少吨?”并与学生一起分析解题方法并在黑板上列出解题步骤,使学生了解过量计算的方法和步骤。
(11)投影练习2:5.85 g的食盐与8 g 98%的浓硫酸在微热条件下反应,问能制取标准状况下的氯化氢气体多少升?若将反应后的混合物加热至强热,则又能生成标准状况下的氯化氢气体多少升?
2.流程图








1.设计思想
物质的量的相关计算可以说是贯穿高中化学的重点内容,这一节中物质的量、物质的量浓度、气体摩尔体积等应用于化学方程式的计算,实际上是前面所学知识和技能的综合运用,涉及中学化学反应中许多有关的物理量及各物理量间的换算,综合性很强,由于学生已经在初中掌握了物质的量和化学方程式中物质的量的计算,本节将通过讲解、讨论法对过量计算及气体摩尔体积、物质的量浓度在化学方程式中的计算问题进行教学并安排三个例题和在概念性以及综合性上逐步增加的练习,适当分解难点达到教学目标,逐步培养学生综合运用知识和技能的能力。
多媒体设备
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com