
本节课采用先归纳后演绎的设计思路。先通过氯、溴、碘单质之间置换反应的探究实验和氯、溴、碘与氢气化合的数据,归纳出氯、溴、碘化学活泼性的递变规律。然后探本溯源,从原子结构上寻找原因,归纳出氯、溴、碘原子结构上的相似性和差异性。再根据结构上的规律,来演绎说明氯、溴、碘物理性质上表现出的规律。结构与性质的关系是整节课的主线,归纳与演绎的科学方法则贯穿其中。
课程标准对溴和碘的化学性质要求很低,为保证实验探究和科学方法教学目标的真正落实,建议一般学校不要随意作知识点上的拓展。
浦东教育发展研究院 周玉枝
5.课后作业
寻找能证明氯、溴、碘化学活泼性变化规律的其他证据。
4.形成知识网络
(1)原子结构的相似性和递变性
|
元素名称 |
氯 |
溴 |
碘 |
|
元素符号 |
Cl |
Br |
I |
|
核电荷数 |
17 |
35 |
53 |
|
最外层电子数 |
7 |
7 |
7 |
|
核外电子层数 |
3 |
4 |
5 |
|
原子半径的变化 |
 依次增大 依次增大 |
(2)氯、溴、碘物理、化学性质的相似性和递变性
|
物质 |
氯(Cl2) |
溴(Br2) |
碘(I2) |
|
|
物理性质 |
状态 |
气体 |
液体 |
固体 |
|
颜色 |
黄绿色 |
深棕红色 |
紫黑色 |
|
|
密度的变化 |
 逐渐变大 逐渐变大 |
|||
|
沸点、熔点 |
 逐渐升高 逐渐升高 |
|||
|
化学性质 |
置换反应 |
能把溴和碘从它们的盐溶液中置换出来 |
能把碘从它的盐溶液中置换出来 |
不能把氯和溴从它们的盐溶液中置换出来 |
|
跟氢气的化合 |
剧烈化合而发生爆炸,HCl较稳定 |
500℃才缓慢反应,HBr较不稳定 |
不断加热时缓慢反应,HI很不稳定,同时分解 |
3.结构决定性质。
为什么氯、溴、碘的化学性质会呈现出一定的变化规律呢?我们知道结构决定性质,同学们能不能从微观的角度、从氯、溴、碘原子的结构来分析一下原因呢?请同学们填写下表,仔细比较它们的相同点和不同点,思考并讨论:怎样从卤原子结构的异同点来解释卤素单质化学性质的差异性和相似性呢?
|
元素名称 |
氯 |
溴 |
碘 |
|
元素符号 |
|
|
|
|
核电荷数 |
|
|
|
|
最外层电子数 |
|
|
|
|
核外电子层数 |
|
|
|
|
原子半径的变化 |
|
解释原因:卤素原子的最外层上都有7个电子,由于化学性质主要由原子的最外层电子数决定。所以Cl2、Br2、I2的化学性质相似,容易形成8电子稳定结构,所以都是活泼的非金属单质。但随着核电荷数的增大,电子层数分别为2、3、4、5,原子核对外层电子的引力越来越弱,所以得到电子能力也越来越弱,也就越难形成8电子稳定结构,所以卤素单质活泼性逐渐减小,呈现一定的变化规律,这就是卤素单质的化学性质呈现一定的变化规律的原因。
1.以旧引新,实验探究
同学们还记得吗?在初三我们是用什么方法来比较铁、铜、银三种金属的化学活泼性的?对,根据较活泼的金属可以将较不活泼的金属从它们的盐溶液中置换出来的性质,我们曾经设计过用硝酸亚铁、硝酸铜和硝酸银溶液与铁、铜、银三种单质的置换反应能否发生来判断这三种金属的化学活泼性。那么,活泼性不同的非金属之间是否也能发生这样的置换反应呢?
与金属间的置换反应原理相类似,我们也可以通过非金属单质间能否发生置换反应来探究非金属单质的化学活泼性大小。如果一种非金属单质能把另一种非金属从它的盐溶液中置换出来,说明前者的活泼性大于后者,反之后者的活泼性大于前者。请同学们根据老师提供的化学试剂,四个人一组,小组合作开展探究活动,设计探究氯、溴、碘化学活泼性顺序的实验方案并进行小组实验,完成课本P46-47的实验报告。

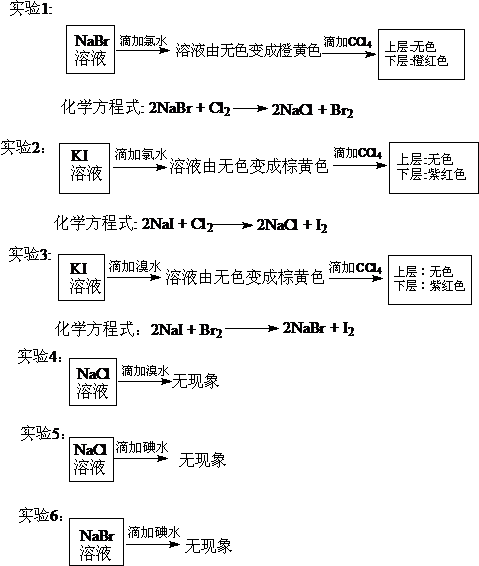
实验结论:化学活泼性: Cl2>Br2>I2 。
2.流程图




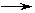



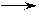
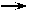






1.设计思想
传统的元素化合物知识的教学,大多采用讲授的方式,然后用演示实验来验证。二期课改重视学生的全面发展,元素化合物知识教学的意义不仅是让学生获得知识,更在于让学生去体验知识、原理的学习过程。使学生了解自然科学研究的一般过程,培养学生的探究能力。为此,本节课采用“引导-探究”教学模式,通过问题、假设和结论,使学生在获得知识的同时,体会科学研究的一般过程和方法。
验证性实验不是照方抓药,探究性实验也不是放任自流,探究性实验中要充分发挥教师的指导作用,教师要为学生搭建支架,在关键处给予学生及时的点拨与启发。
试管、胶头滴管、新制饱和氯水、NaBr溶液、KI溶液、溴水、四氯化碳。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com