
1.实验室里所用的药品,很多是易燃、易爆、有腐蚀性或有毒的。因此在使用时一定要严格遵照
有关规定和操作规程,保证安全。不能用手接触药品,不要把鼻孔凑到容器口去闻药品(特别
是气体)的气味,不得尝任何药品的味道。注意节约药品,严格按照实验规定的用量取用药品。
如果没有说明用量,一般应按最少量取用:液体l-2mL,固体只需要盖满试管底部。
 实验剩余的药品既不能放回原瓶,也不要随意丢弃,更不要拿出实验室,要放入指定的容器内。
实验剩余的药品既不能放回原瓶,也不要随意丢弃,更不要拿出实验室,要放入指定的容器内。
 2.固体药品的取用
2.固体药品的取用
取用固体药品一般用药匙。往试管里装入固体粉末时,为避免药品沾在管口和管壁上,先使试
管倾斜,把盛有药品的药匙(或用小纸条折叠成的纸槽)小心地送入试管底部,然后使试管直
 立起来,让药品全部落到底部。有些块状的药品可用镊子夹取。
立起来,让药品全部落到底部。有些块状的药品可用镊子夹取。
玻璃仪器洗净的标准是:
内壁上附着的水膜均匀,
既不聚成水滴,也不成股流下。
本课设计的亮点是“过程与方法目标”的落实,其关键有三:一是b和c部分的“发现1”和“发现2”,引导同学分析找到“在有得氧或失氧的化学反应中一定有元素发生了化合价的改变”,一定要改变以往由教师直接给出结论的老方法,由同学自己分析讨论并得出结论;二是d部分,怎样对概念进行“提炼”(记忆方法),要通过同学间讨论得到“升、失、氧、本身是还原剂”的核心结论。三是重现从“得失氧说”到“化合价升降说”和“电子转移说”的人们认识客观事物的过程。
“情感态度与价值观”目标贯穿于整节课,其中对“得与失”、“升与降”、“氧化与还原”等的理解是该目标的具体体现。
本设计抓住氧化、还原、氧化还原反应、氧化剂、还原剂这个重点,采用体验学习方法,分层推进,使同学在循序渐进的探究中不断体验成功的喜悦。本课应用电化教学的方法,既使课堂气氛生动活泼,吸引学生集中注意,培养了学习兴趣,发展了学习情感。同时又节省了大量板书时间,使课堂紧凑。本课还创设问题情境、制造悬念,使学生不断积极思考,不断产生问题,解决问题。激发了学习动机,培养了学习兴趣;课始终在教师和学生的共同活动中进行,通过提问、讨论、板演,构成一个民主和谐的氛围,激发学习激情。本课始终围绕氧化与还原这一对矛盾,揭示辩正唯物主义观点,特别对矛盾的普遍性、统一性、物质的现象与本质有了进一步认识,这些都将潜移默化、内化为学生的价值观。实践证明,只要我们不断创设教学情境,激发学习动力,就能收到较好的教学效果。
华东师范大学附属东昌中学 吴民生
8.课后作业
略。
7.讨论
(1)2KMnO4 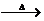 K2MnO4
+ MnO2 + O2↑的反应。氧化剂和还原剂是什么?什么元素被氧化?什么元素被还原?被氧化的元素生成什么物质?被还原的物质生成什么物质?化合价升高的总数是多少?化合价降低的总数是多少?电子是怎样转移的?电子转移的数目是多少?你是怎样计算的?还可以怎样计算?
K2MnO4
+ MnO2 + O2↑的反应。氧化剂和还原剂是什么?什么元素被氧化?什么元素被还原?被氧化的元素生成什么物质?被还原的物质生成什么物质?化合价升高的总数是多少?化合价降低的总数是多少?电子是怎样转移的?电子转移的数目是多少?你是怎样计算的?还可以怎样计算?
(2)有人说“氯气只有氧化性,没有还原性”,请说出你的观点,并简述理由。
6.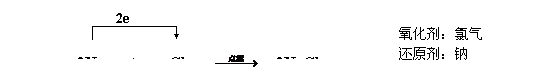
 总结应用
总结应用
(1)有电子转移(得失或偏移)的反应都是氧化还原反应。
(2)有电子转移的反应就是非氧化还原反应。
(3)氧化还原反应的有关概念
“升、失、氧;本身是还原剂”。
有单质参加或生成的化合或分解反应一般是氧化还原反应,置换反应都是氧化还原反应,复分解反应都不是氧化还原反应;
元素处于最高价时只有氧化性,元素处于最低价时只有还原性,元素处于中间价态时既有氧化性又有还原性;
5.表达训练
口头表达训练:略。
书面表达训练:
书面表达训练时,参照课本P49第4行和P50第一行形成以下规范:
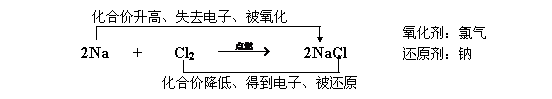
 参照课本P50第5行形成以下规范:
参照课本P50第5行形成以下规范:
4.氧化还原反应的“电子转移说”
Zn + H2SO4 → ZnSO4 + H2↑的反应是氧化还原反应吗?
[演示实验]:锌铜原电池,用发光二极管或演示用检流计检验电流。
金属钠与氯气反应是氧化还原反应吗?
“动画演示”钠原子与氯原子作用生成氯化钠的微观过程。
为什么实验中有电流产生?是什么因素引起钠和氯化合价变化的?并与氧化反应和还原反应相关联,恰当引导,让同学开阔视野,让同学体验发现新知识的过程。发现电子得失与氧化还原反应的关系。
指出:早在1800年意大利科学家A.伏打就制成电堆,1833年英国科学家M.法拉第提出电解定律,直到1881年英国科学家汤姆逊(1856-1940)发现电子,人们又开始关注电子与氧化还原反应的联系。同学们的发现又更加深入了。
分析制取氧气的反应:2KClO3  2KCl + 3O2↑,从电子转移的角度说明:氧化反应、还原反应、氧化还原反应、氧化剂、还原剂。
2KCl + 3O2↑,从电子转移的角度说明:氧化反应、还原反应、氧化还原反应、氧化剂、还原剂。
[发现2]:化学反应中有电子转移的反应是氧化还原反应;
得电子的物质是氧化剂,得到电子的元素发生还原反应(被还原);失电子的物质是还原剂,失去电子的元素氧化反应(被氧化);
在氧化还原反应中,元素化合价变化只是表象(特征),电子转移才是氧化还原反应的本质。
得失电子也总是同时存在,氧化剂还原剂同时存在,氧化反应还原反应同时发生,氧化产物还原产物同时生成。真是一对冤家对头。
氧化还原反应的本质是反应中有电子转移;失去电子的总数必定等于得到电子的总数;
提练概念:请同学设法记忆“得失氧说”与“化合价升降说”涉及的有关概念。
“升、失、氧;降、得、还”。
3.氧化还原反应的“化合价升降说”
问题讨论:
分析上表的两个反应,在反应前后除了发生了得氧和失氧的变化外,还有什么变化?
对几位学生的回答加以评述,恰当引导,让同学开阔视野,让同学体验发现新知识的过程。发现化合价与氧化还原反应有关系:
指出:公元1852年英国E.弗兰克兰提出原子价概念(后发展成为化合价理论),人们从化合价的角度去分析氧化还原反应,同学们的发现已进了一步。
在反应Fe2O3 + 3CO 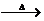 2Fe + 3CO2 中:
2Fe + 3CO2 中:
CO  CO2是氧化反应,碳元素的化合价从+2价变化到+4价;
CO2是氧化反应,碳元素的化合价从+2价变化到+4价;
在反应CuO + H2 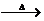 Cu
+ H2O中:
Cu
+ H2O中:
CuO 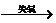 Cu是还原反应,铜元素的化合价从+2价变化到0价。
Cu是还原反应,铜元素的化合价从+2价变化到0价。
反应H2 + Cl2 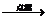 2HCl 是氧化还原反应吗?………………………………③
2HCl 是氧化还原反应吗?………………………………③
反应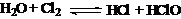 是氧化还原反应吗?………………………………④
是氧化还原反应吗?………………………………④
从化合价升降的角度说明:氧化反应、还原反应、氧化还原反应、氧化剂、还原剂。
[发现1]:化学反应中有元素化合价发生变化的反应是氧化还原反应;
化合价升高的物质是还原剂,化合价升高的元素发生氧化反应(被氧化);化合价降低的物质是氧化剂,化合价降低的元素发生还原反应(被还原);化合价的升降总是同时存在。
化学反应中有元素化合价发生改变的反应是氧化还原反应;化合价升高的总数必定等于化合价降低的总数;
评价“得失氧说”与“化合价升降说”科学(合理)性。摈弃“得失氧说”
2.氧化还原反应的“得失氧说”
根据“得失氧理论”,说明:氧化反应、还原反应、氧化还原反应、氧化剂、还原剂。举例:
Fe2O3 + 3CO 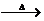 2Fe + 3CO2 ………………………………………①
2Fe + 3CO2 ………………………………………①
CuO + H2 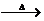 Cu + H2O …………………………………………………②
Cu + H2O …………………………………………………②
提供氧的物质是氧化剂,发生还原反应;得到氧的物质是还原剂,发生氧化反应;
得氧与失氧总是同时存在。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com