

2、弹簧振子振动周期:T=2 ,只由振子质量和弹簧的劲度决定,与振幅无关,也与弹簧振动情况(如水平方向振动或竖直方向振动或在光滑的斜面上振动或在地球上或在月球上或在绕地球运转的人造卫星上)无关。
,只由振子质量和弹簧的劲度决定,与振幅无关,也与弹簧振动情况(如水平方向振动或竖直方向振动或在光滑的斜面上振动或在地球上或在月球上或在绕地球运转的人造卫星上)无关。
1、一个可作为质点的小球与一根弹性很好且不计质量的弹簧相连组成一个弹簧振子.一般来讲,弹簧振子的回复力是弹力(水平的弹簧振子)或弹力和重力的合力(竖直的弹簧振子)提供的.弹簧振子与质点一样,是一个理想的物理模型.
2、简谐振动:物体所受的回复力跟位移大小成正比时,物体的振动是简偕振动.
①受力特征:回复力F=-KX。
②运动特征:加速度a=一kx/m,方向与位移方向相反,总指向平衡位置。简谐运动是一种变加速运动,在平衡位置时,速度最大,加速度为零;在最大位移处,速度为零,加速度最大。
说明:①判断一个振动是否为简谐运动的依据是看该振动中是否满足上述受力特征或运动特征。
②简谐运动中涉及的位移、速率、加速度的参考点,都是平衡位置.
[例1]如图所示,轻质弹簧上端固定,下端连结一小球,平衡时小球处于O位置,现将小球由O位置再下拉一小段距离后释放(在弹性限度内),试证明释放后小球的上下振动是简谐振动,
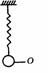 证明:设小球的质量为m,弹簧的劲度系数为k,小球处在O位置有:mg-kΔx=0………①
证明:设小球的质量为m,弹簧的劲度系数为k,小球处在O位置有:mg-kΔx=0………①
式中Δx为小球处在O位置时弹簧的伸长量.
再设小球离开O点的位移x(比如在O点的下方),并取x为矢量正方向,此时小球受到的合外力∑Fx为:∑Fx =mg-k(x+Δx)②
由①②两式可得:∑Fx =-kx, 所以小球的振动是简谐振动,O点即其振动的平衡位置.
点评:这里的F=-kx,不是弹簧的弹力,而是弹力与重力的合力,即振动物体的回复力.此时弹力为k(x+Δx);所以求回复力时F=kx,x是相对平衡位置的位移,而不是相对弹簧原长的位移.
1、振动描述的物理量
(1)位移:由平衡位置指向振动质点所在位置的有向线段.
①是矢量,其最大值等于振幅;②始点是平衡位置,所以跟回复力方向永远相反;③位移随时间的变化图线就是振动图象.
(2)振幅:离开平衡位置的最大距离.
①是标量; ②表示振动的强弱;
(3)周期和频率:完成一次全变化所用的时间为周期T,每秒钟完成全变化的次数为频率f.
①二者都表示振动的快慢;②二者互为倒数;T=1/f;③当T和f由振动系统本身的性质决定时(非受迫振动),则叫固有频率与固有周期是定值,固有周期和固有频率与物体所处的状态无关.
21.下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质 (一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
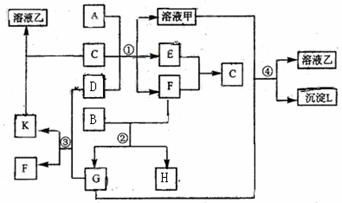
(1)A、D代表的物质分别为 、 (填名称);
 并写出D的两个用途
;
并写出D的两个用途
;
(2)反应①中的C、D均过量,则该反应的化学方程式是 ;
同时 写出反应④的离子方程式为 。
(3)反应②中,若B与F物质的量之比为5∶4,则反应②的化学方程式为
2010届岳西中学、野寨中学
20.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号),
反应中得到的氧化产物是
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3。 d.用浓硫酸吸收 e.用氨水吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程。 、 。(此处离子方程式可不配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。
方法为:
①用稀盐酸浸取炉渣,过滤。过滤所用的玻璃仪器是
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.检验沉淀是否洗涤干净的方法是
b.滤液先氧化,选取的氧化剂最好是: (只要求一种)
提供的试剂: KSCN溶液、 稀硝酸、 稀盐酸、 碘水、 稀硫酸 、 KMnO4溶液 、 NaOH溶液、双氧水。
c.炉渣中AI2O3除去的离子方程式是 。
19.某同学为了测定三聚氰胺的分子式和结构简式,设计了如下实验:
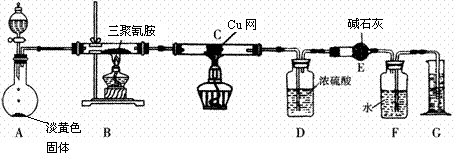
查阅资料:三聚氰胺的相对分子质量为126,三聚氰胺在常温下呈晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。取12.6 g的三聚氰胺晶体按如图装置进行实验(假设三聚氰胺完全反应转化成产物)。
(1)写出A装置中发生反应的化学方程式 ;
(2)D装置能不能与E装置互换?为什么? ;
(3)当B装置中反应完全发生后,读取G中水的体积的实验操作顺序为 (填序号);
①读数 ②冷却至室温 ③调平F、G装置中的液面
(4)测定数据如下:
|
装置 |
D |
E |
|
实验前 |
101.9 g |
55.8 g |
|
实验后 |
107.3 g |
69.0 g |
经测定,F中收集的气体折合标准状况下的体积为6720ml。
已知在三聚氰胺分子中存在类似于苯环结构的六元环,试写出三聚氰胺的结构简式 ;
18.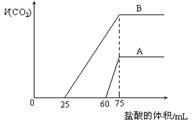 取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间关系如图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间关系如图所示,试回答下列问题:
①原NaOH溶液的物质的量浓度为 。
②曲 线A表明,原NaOH溶液中通入CO2后,
线A表明,原NaOH溶液中通入CO2后,
所得溶液中溶质的物质的量之比为 。
③曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为  mL。
mL。
17.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:
A(g) + xB(g)  2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率
随时间变化的关系如下图所示。 请回答下列问题:
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率
随时间变化的关系如下图所示。 请回答下列问题:

⑴30min时改变的条件是 。
⑵反应过程中B的转化率最大的时间段是 min。
⑶该反应的ΔH 0(填:“>”、“=”或“<”)。
⑷有甲、乙两个完全相同的容器,向甲容器中加入1 molA(g)和2x molB(g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2molC(g) 和x molB(g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中A的转化率为 。
16.X、Y、Z为短周期元素的单质,A、B为它们的化合物,这些物质之间的关系
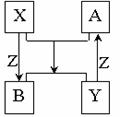 如下图所示,其中反应条件和某些产物已经略去:
如下图所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,
写出反应“A+X→B+Y”的化学反应方程式:
①若已知B 是水: ;
②若已知A、B均为氧化物 。
(2)如果X、Y的组成元素在不同主族,且X元素在自然界中
形成的化合物种类最多,分布极广,则A+X→B+Y化学方程式为____________。
(3)如果X、Y的组成元素在同一周期,则Z单质为__________(写名称)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com