
20.(15分)某课外小组利用H2还原黄色的WO3粉末测定W元素的相对原子质量,下图是测量装置的示意图,A中的试剂是盐酸。
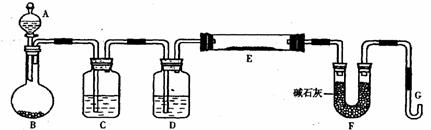
请回答下列问题:
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是 ;
(2)试剂C是水,其作用是 ;
(3)试剂D是 ,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是 (填操作序号)
①检验氢气纯度
②加热E
③检验装置气密性
④点燃G管溢出的气体
⑤从A瓶逐滴滴加液体
(5)从实验中测得了下列数据
①空E管的质量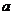 ;
;
②E管和WO3的总质量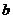 ;
;
③反应后E管和W粉的总质量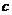 (冷却到温室称量);
(冷却到温室称量);
④反应前F管及内盛物的总质量 ;
;
⑤反应后F管及内盛物的总质量 ;
;
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算1:Ar(W)= ;
计算2:Ar(W)= 。
19.(18分)氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨。下图是合成氨的简要流程。
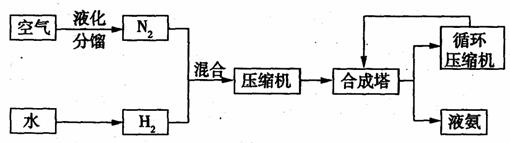
(1)下表是空气中部分气体的沸点。将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是 。
|
气体名称 |
氨气 |
氧气 |
氦气 |
氖气 |
氩气 |
氪气 |
氚气 |
|
沸点/℃ |
-196 |
-183 |
-269 |
-264 |
-186 |
-153 |
-108 |
(2)天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料的相对投资和能量消耗。
|
原料 |
天然气 |
重油 |
煤 |
|
相对投资费用 |
1.0 |
1.5 |
2.0 |
|
能量消耗/J·t-1 |
28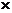 109 109 |
38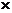 109 109 |
48 109 109 |
①依据上表信息,你认为采用 为原料最好。
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式: 。
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)===CO2(g) △H=-394kJ·mol-1;
2CO(g)+O2(g)===2CO2(g)△H=-566kJ·mol-1;
2H2(g)+O2(g)===2H2O(g) △H=-484 kJ·mol-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
。
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据。


|
0.1 |
10 |
20 |
30 |
60 |
100 |
||||||
|
200 |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
||||||
|
300 |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
||||||
|
400 |
0.4 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
||||||
|
500 |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
||||||
|
600 |
0.05 |
4.5 |
9.1 |
13.8 |
23.1 |
31.4 |
|
|
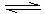 NH3的△H (填“>”、“<”或“无法判断”
NH3的△H (填“>”、“<”或“无法判断” 0,请简要说明理由
;
0,请简要说明理由
;
②该反应的化学平衡常数表达式为 。
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
倍。
18.(12分)有X、Y、Z、W四种短周期主族元素,原子序数依次增大。X元素与其它元素不在同一周期。Y、Z在同周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。W原子的最外层电子数是核外电子层数的2倍。请回答:
(1)W在元素周期表位置 。
(2)写出X与Z形成的10电子阳离子的化学式 。
(3)由上述四种元素中的某两种元素所形成的具有漂白作用的物质的化学式是:
(任意写一种)。
(4)W的最高价氧化物的水化物有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为 。
(5)由X、Y、Z、W四种元素组成的多种无机酸酸式盐,写出其中一种与足量的NaOH溶液在加热条件下反应的离子方程式为: 。
17.(6分)工业上冶炼铝的原料是铝土矿(主要成份为Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)写出X、Y的化学式:X ,Y ;
(2)通入过量CO2时反应的离子方程式为 。
16.(4分)下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液。

(1)该转化系统可以循环使用的化合物是 。
(2)电解系统中的阳极反应式: 。
15.有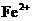 、
、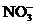 、
、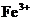 、
、 、
、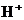 和
和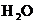 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是 ( )
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是 ( )
A.氧化剂和还原剂的物质的量之比为1:8
B.该过程说明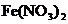 溶液不宜加酸酸化
溶液不宜加酸酸化
C.每1 mol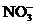 发生氧化反应,转移8 mol e-
发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为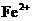
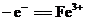
14.根据下表信息,判断以下叙述正确的是 ( )
部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/mm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的稳定性为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
13.某无色混合盐溶液中,除水电离产生的离子外可能含有
|
步骤 |
操作 |
现象 |
|
(1) |
用pH试纸检验 |
溶液的pH大于7 |
|
(2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
(3) |
分液,向所得水溶液中加入Ba(NO3)
2溶液和稀HNO3 |
有白色沉淀产生 |
|
(4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
下列结论正确的是 ( )
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是① D.只有确定④存在,②不存在
12.两种一元碱MOH和ROH的溶液分别加水稀释,溶液
pH的变化如图所示,下列叙述不正确的是( )
A.ROH是一种强碱
B.在x点,c(M+)=c(R+)
C.在x点,ROH完全电离
D.稀释前,c(ROH)=10c(MOH)
11.根据化学知识,下列说法正确的是 ( )
A.仅由非金属元素组成的化合物一定是共价化合物
B.普通陶瓷、玻璃、水泥是使用量最大的无机材料,其生产都采用含硅元素的原料
C.同一温度下,向饱和AgCl溶液中加入盐酸,AgCl的KSP变大
 D.某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶了较多的CO2
D.某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶了较多的CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com